题目内容
下表列出了某短周期元素R的各级电离能数据(用I1、I2…表示,单位为kJ?mol-1).
下列关于元素R的判断中一定正确的是( )
| I1 | I2 | I3 | I4 | … | |
| R | 740 | 1 500 | 7 700 | 10 500 | … |
| A、R的最高正价为+3价 |
| B、R元素位于元素周期表中第ⅡA族 |
| C、R元素的原子最外层共有4个电子 |
| D、R元素基态原子的电子排布式为1s22s22p1 |
考点:元素电离能、电负性的含义及应用
专题:元素周期律与元素周期表专题
分析:根据第一至第四电离能的变化可判断出各元素的最高化合价,进而推断元素的种类,及元素原子结构.
解答:
解:从表中原子的第一至第四电离能可以看出,元素的第一、第二电离能都较小,可失去2个电子,最高化合价为+2价,即最外层应有2个电子,应为第IIA族元素.
A、最外层应有2个电子,所以R的最高正价为+2价,故A错误;
B、最外层应有2个电子,所以R元素位于元素周期表中第ⅡA族,故B正确;
C、R元素的原子最外层共有2个电子,故C错误;
D、R元素可能是Mg或Be,故D错误;
故选B.
A、最外层应有2个电子,所以R的最高正价为+2价,故A错误;
B、最外层应有2个电子,所以R元素位于元素周期表中第ⅡA族,故B正确;
C、R元素的原子最外层共有2个电子,故C错误;
D、R元素可能是Mg或Be,故D错误;
故选B.
点评:本题考查元素电离能含义及应用,难度不大,注意知识的积累.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
500mL 1mol/L的稀HCl与锌粒反应,不会使反应速率加快的是( )
| A、升高温度 |
| B、将500 mL 1 mol/L的HCl改为1000 mL 1 mol/L的HCl |
| C、用1 mol/L的H2SO4代替1 mol/L的HCl |
| D、用锌粉代替锌粒 |
 空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )| A、b极上发生的电极反应是:4H2O+4e-═2H2↑+4OH- |
| B、d极上发生的电极反应是:O2+4H++4e-═2H2O |
| C、c极上进行还原反应,B中的H+可通过隔膜进入A |
| D、当有0.1 mol电子转移时,a极产生1.12 L O2(标准状况下) |
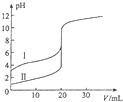 室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100mol/L 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )
室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100mol/L 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )| A、Ⅱ表示的是滴定醋酸的曲线 |
| B、PH=7时,滴定醋酸消耗V(NaOH)小于20ml |
| C、V(NaOH)=20ml时,C(Cl-)=C(CH3COO-) |
| D、V(NaOH)=10ml时,醋酸溶液中:C(Na+)>C(CH3COO- )>C(H+)>C(OH- ) |
下列试验中需要用到温度计的是( )
| A、分离NaCl和SiO2 |
| B、.从溶液中蒸发得到晶体 |
| C、.分离酒精和水 |
| D、.分离汽油和水 |
以石墨作电极电解下列溶液,电解后加入括号内的物质不能使电解质溶液恢复原状的是( )
| A、CuCl2溶液(CuCl2) |
| B、CuSO4溶液(CuO) |
| C、NaCl溶液(HCl) |
| D、KNO3溶液(KNO3) |
