题目内容
下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
(1)在标号元素中,最活泼的金属元素是 .最活泼的非金属元素是 .⑨元素的离子结构简示意图 .
(2)①与②形成共价化合物的电子式 .用电子式表示⑤与⑨形成化合物的形成过程 .
(3)⑤、⑥、⑦三种元素的原子半径由大到小的顺序是 .
(4)⑦、⑧、⑨元素所形成的气态氢化物中,最稳定的是 .⑦、⑧、⑨三种元素的最高价含氧酸的酸性由强到弱的顺序 .
(5)写出⑥元素的单质与盐酸反应的离子方程式: .
(6)③、⑦两种元素形成的化合物与①、③、⑤三种元素形成的化合物形成的化合物发生反应,写出该反应的离子方程式 .
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)①与②形成共价化合物的电子式
(3)⑤、⑥、⑦三种元素的原子半径由大到小的顺序是
(4)⑦、⑧、⑨元素所形成的气态氢化物中,最稳定的是
(5)写出⑥元素的单质与盐酸反应的离子方程式:
(6)③、⑦两种元素形成的化合物与①、③、⑤三种元素形成的化合物形成的化合物发生反应,写出该反应的离子方程式
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置可知①为H、②为C、③为O、④为F、⑤为Na、⑥为Al、⑦为Si、⑧为P、⑨为Cl.
(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱;氯离子核外有18个电子,有3个电子层,各层电子数为2、8、8;
(2)①与②形成共价化合物为CH4,分子中C原子与H原子之间形成1对共用电子对;⑤与⑨形成化合物为NaCl,由钠离子与氯离子构成,用Na原子、Cl原子电子式表示其形成过程;
(3)同周期自左而右原子半径减小;
(4)同周期自左而右非金属性增强,非金属性越强,氢化物越稳定、最高价含氧酸的酸性越强;
(5)铝与盐酸反应生成氯化铝与氢气;
(6)③、⑦两种元素形成的化合物为二氧化硅,①、③、⑤三种元素形成的化合物形成的化合物为NaOH,二者反应生成硅酸钠与水.
(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱;氯离子核外有18个电子,有3个电子层,各层电子数为2、8、8;
(2)①与②形成共价化合物为CH4,分子中C原子与H原子之间形成1对共用电子对;⑤与⑨形成化合物为NaCl,由钠离子与氯离子构成,用Na原子、Cl原子电子式表示其形成过程;
(3)同周期自左而右原子半径减小;
(4)同周期自左而右非金属性增强,非金属性越强,氢化物越稳定、最高价含氧酸的酸性越强;
(5)铝与盐酸反应生成氯化铝与氢气;
(6)③、⑦两种元素形成的化合物为二氧化硅,①、③、⑤三种元素形成的化合物形成的化合物为NaOH,二者反应生成硅酸钠与水.
解答:
解:由元素在周期表中位置可知①为H、②为C、③为O、④为F、⑤为Na、⑥为Al、⑦为Si、⑧为P、⑨为Cl.
(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中Na的金属性最强,F的非金属性最强;氯离子核外有18个电子,有3个电子层,各层电子数为2、8、8,离子结构示意图为: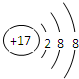 ,故答案为:Na;F;
,故答案为:Na;F; ;
;
(2)①与②形成共价化合物为CH4,分子中C原子与H原子之间形成1对共用电子对,其电子式为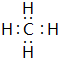 ;⑤与⑨形成化合物为NaCl,由钠离子与氯离子构成,用Na原子、Cl原子电子式表示其形成过程为:
;⑤与⑨形成化合物为NaCl,由钠离子与氯离子构成,用Na原子、Cl原子电子式表示其形成过程为: ,
,
故答案为: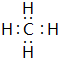 ;
; ;
;
(3)同周期自左而右原子半径减小,故原子半径:Na>Al>Si,故答案为:Na>Al>Si;
(4)同周期自左而右非金属性增强,非金属性越强,氢化物越稳,氢化物稳定性HCl>PH3>SiH4,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>H3PO4>H2SiO3 ,故答案为:HCl;HClO4>H3PO4>H2SiO3 ;
(5)铝与盐酸反应生成氯化铝与氢气,反应离子方程式为:2Al+6H+=2Al3++3H2↑,故答案为:2Al+6H+=2Al3++3H2↑;
(6)③、⑦两种元素形成的化合物为二氧化硅,①、③、⑤三种元素形成的化合物形成的化合物为NaOH,二者反应生成硅酸钠与水,反应离子方程式为:SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O.
(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中Na的金属性最强,F的非金属性最强;氯离子核外有18个电子,有3个电子层,各层电子数为2、8、8,离子结构示意图为:
 ,故答案为:Na;F;
,故答案为:Na;F; ;
;(2)①与②形成共价化合物为CH4,分子中C原子与H原子之间形成1对共用电子对,其电子式为
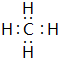 ;⑤与⑨形成化合物为NaCl,由钠离子与氯离子构成,用Na原子、Cl原子电子式表示其形成过程为:
;⑤与⑨形成化合物为NaCl,由钠离子与氯离子构成,用Na原子、Cl原子电子式表示其形成过程为: ,
,故答案为:
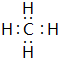 ;
; ;
;(3)同周期自左而右原子半径减小,故原子半径:Na>Al>Si,故答案为:Na>Al>Si;
(4)同周期自左而右非金属性增强,非金属性越强,氢化物越稳,氢化物稳定性HCl>PH3>SiH4,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>H3PO4>H2SiO3 ,故答案为:HCl;HClO4>H3PO4>H2SiO3 ;
(5)铝与盐酸反应生成氯化铝与氢气,反应离子方程式为:2Al+6H+=2Al3++3H2↑,故答案为:2Al+6H+=2Al3++3H2↑;
(6)③、⑦两种元素形成的化合物为二氧化硅,①、③、⑤三种元素形成的化合物形成的化合物为NaOH,二者反应生成硅酸钠与水,反应离子方程式为:SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O.
点评:本题考查元素周期表与元素周期律,侧重对元素周期律与化学用语的考查,注意掌握用电子式表示物质或化学键形成,难度不大.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、64g氧气中含氧分子数为2NA |
| B、1.7g OH-中所含的电子数为NA |
| C、49g硫酸中所含氧原子数为2NA |
| D、58.5g氯化钠中所含的离子数为NA |
设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A、18g水中含有的氢原子数为2NA |
| B、46g二氧化氮和46g四氧化二氮含有的原子数均为3NA |
| C、2mol硝酸镁固体中含有的硝酸根离子数为4NA |
| D、1mol氧中含有的氧原子数为2NA |
 甲、乙两池的电极材料如图所示,请按要求回答下列问题:
甲、乙两池的电极材料如图所示,请按要求回答下列问题:
 科学家用Pb-磷化物催化二氧化碳和丁二烯发生化学反应,得到的主要产物甲的键线式如图所示,请回答下列问题:
科学家用Pb-磷化物催化二氧化碳和丁二烯发生化学反应,得到的主要产物甲的键线式如图所示,请回答下列问题: