题目内容
1.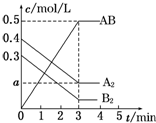 在一个容积为2L的密闭容器中,加入0.8mol A2气体和0.6mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)═2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.下列说法正确的是( )
在一个容积为2L的密闭容器中,加入0.8mol A2气体和0.6mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)═2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.下列说法正确的是( )| A. | 图中a点的值为0.05 | B. | 该反应的平衡常数K=0.03 | ||
| C. | 平衡时A2的转化率为62.5% | D. | 温度升高,平衡常数K值增大 |
分析 A.根据AB的浓度变化结合反应方程式计算A2的浓度变化,从而得出a值;
B.根据化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比进行计算;
C.根据转化的A2的量和A2的初始量求算;
D.根据放出热量即△H<0,所以温度升高,平衡逆移,平衡常数K值减小.
解答 解:A、当AB的浓度改变0.5 mol•L-1,由方程式A2(g)+B2(g)?2AB(g)知,A2的浓度改变为0.25mol•L-1,所以a=(0.4-0.25)mol•L-1=0.15mol•L-1,即图中a点的值为0.15,故A错误;
B、当AB的浓度改变0.5 mol•L-1,由方程式知,B2的浓度改变为0.25mol•L-1,所以平衡时B2的浓度为=(0.3-0.25)mol•L-1=0.05mol•L-1,K=$\frac{{c}^{2}(AB)}{c({A}_{2})•c({B}_{2})}$=$\frac{0.{5}^{2}}{0.15×0.05}$=$\frac{100}{3}$,故B错误;
C.当AB的浓度改变0.5 mol•L-1,由方程式知,A2的浓度改变为0.25mol•L-1,已知A2的初始量为0.4mol•L-1,所以平衡时A2的转化率为:$\frac{0.25}{0.4}$×100%=62.5%,故C正确;
D.反应A2(g)+B2(g)?2AB(g)的△H<0,为放热反应,所以温度升高,平衡逆移,平衡常数K值减小,故D错误;
故选C.
点评 本题考查了化学平衡的计算,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握化学平衡特点及计算方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
6.钛号称“崛起的第三金属”,因具有密度小、强度大、无磁性等优良的机械性能,被广泛应用于军事、医学等领域.已知钛有48Ti、49Ti、50Ti等同位素,下列关于金属钛的叙述中不正确的是( )
| A. | 上述钛原子中,中子数不可能为22 | |
| B. | 钛元素在周期表中处于第四周期ⅡB族 | |
| C. | 钛原子的外围电子层排布为3d24s2 | |
| D. | 钛元素位于元素周期表的d区,是过渡元素 |
10.下列与金属腐蚀有关的说法,正确的是( )
| A. | 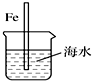 图中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. |  图中,发生吸氧腐蚀 | |
| C. | 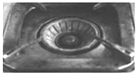 图中,燃烧灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. | 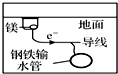 图中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁相当于原电池的正极 |
11.下列离子方程式中,不正确的是( )
| A. | 向FeCl2溶液中通入Cl22Fe2++Cl2═2Fe3++2Clˉ | |
| B. | FeCl3溶液跟过量氨水 Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+ | |
| C. | 碳酸氢钙溶液跟稀硝酸 Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| D. | 钠与水的反应 2Na+2H2O═2Na++2OH-+H2↑ |

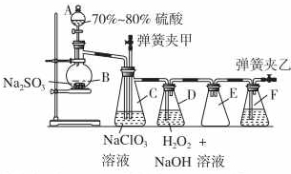 装置C中发生反应:2NaClO3+SO2═2ClO2+Na2SO4 (Ⅰ)
装置C中发生反应:2NaClO3+SO2═2ClO2+Na2SO4 (Ⅰ)