题目内容
7. 某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子.向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如右图所示.下列有关判断正确的是( )
某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子.向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如右图所示.下列有关判断正确的是( )| A. | m点处反应:H++OH-=H2O | |
| B. | 溶液中n(SO42- )=2.5mol | |
| C. | 若取原溶液做焰色反应实验,焰色应为黄色 | |
| D. | 原溶液中存在的主要离子:n(H+ )=n(NH4+ )=n(Al3+ ) |
分析 由图可知,开始加入1mol NaOH没有沉淀和气体产生,则一定有H+;然后加入氢氧化钠有沉淀产生且最后完全消失,则一定没有Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-,据此分析解答.
解答 解:由图可知,开始加入NaOH没有沉淀和气体产生,则一定有H+;后来有沉淀产生且最后完全消失,则一定没有Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-,
A.m点后沉淀的量逐渐增加,发生反应为Al3++3OH-=Al(OH)3↓,故A错误;
B.根据分析可知,无法确定是否含有Na+,则无法计算溶液中n(SO42- ),故B错误;
C.根据分析可知,无法确定是否含有Na+,则取原溶液做焰色反应实验,焰色不一定为黄色,故C错误;
D.开始加入1mol NaOH时,溶液无沉淀产生,说明溶液中有H+,且其物质的量为1mol;产生沉淀和沉淀溶解所需的NaOH的物质的量为3:1,所以溶液中有Al3+且其物质的量为1mol;当加入4~5 mol NaOH时,发生的反应为NH4++OH-═NH3•H2O,所以溶液中NH4+为1mol,则原溶液中n(H+)=n(NH4+)=n(Al3+),故D正确;
故选D.
点评 本题考查了离子反应、离子的鉴别,题目难度中等,熟悉相关离子的性质、明确图象中各段的含义及发生的反应是解题关键,注意铝离子的性质,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.已知: ,由于醚键比较稳定故利用 此反应可保护醛基,也可以合成缩醛类有机物,下列说法中不正确的是( )
,由于醚键比较稳定故利用 此反应可保护醛基,也可以合成缩醛类有机物,下列说法中不正确的是( )
 ,由于醚键比较稳定故利用 此反应可保护醛基,也可以合成缩醛类有机物,下列说法中不正确的是( )
,由于醚键比较稳定故利用 此反应可保护醛基,也可以合成缩醛类有机物,下列说法中不正确的是( )| A. | 保护 1mol 醛基时也可用2molCH3CH2OH | |
| B. | 合成 1mol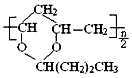 需要 1mol 需要 1mol 和 nmolCH3CH2CH2CHO 和 nmolCH3CH2CH2CHO | |
| C. | 通过上述反应合成的 其核磁共振氢谱中峰面积之比为1:1:1:1:1:2:2:3 其核磁共振氢谱中峰面积之比为1:1:1:1:1:2:2:3 | |
| D. | 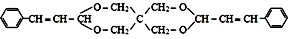 可由 C(CH2OH)4 与 可由 C(CH2OH)4 与 通过上述反应得到 通过上述反应得到 |
18. 有机物A、B均为合成某种抗支气管哮喘药物的中间体,如图所示,A在一定条件下可转化为B,下列说法错误的是( )
有机物A、B均为合成某种抗支气管哮喘药物的中间体,如图所示,A在一定条件下可转化为B,下列说法错误的是( )
 有机物A、B均为合成某种抗支气管哮喘药物的中间体,如图所示,A在一定条件下可转化为B,下列说法错误的是( )
有机物A、B均为合成某种抗支气管哮喘药物的中间体,如图所示,A在一定条件下可转化为B,下列说法错误的是( )| A. | 分子B中只含有3种官能团 | |
| B. | 分子A中所有碳原子不可能位于同一平面 | |
| C. | 分子B能发生银镜反应,但不能发生水解反应 | |
| D. | 用FeCl3溶液可检验物质B中是否混有A |
15.已知:2KNO3(s)=2KNO2(s)+O2(g)△H1=+242.44kJ/mol
C(s)+O2(g)=CO2(g)△H2=-392.00kJ/mol
为提供1mol KNO3分解所需的热量,理论上需要燃烧碳( )
C(s)+O2(g)=CO2(g)△H2=-392.00kJ/mol
为提供1mol KNO3分解所需的热量,理论上需要燃烧碳( )
| A. | $\frac{△{H}_{1}}{△{H}_{2}}$mol | B. | $\frac{2△{H}_{1}}{△{H}_{2}}$mol | C. | $\frac{△{H}_{1}}{2△{H}_{2}}$mol | D. | -$\frac{△{H}_{1}}{2△{H}_{2}}$mol |
2.现有下列试剂:(1)氯水 (2)Br2水 (3)碘水 (4)碘酒 溶液,其中能使淀粉碘化钾溶液变蓝的是( )
| A. | 除(3)外 | B. | 除(4)外 | C. | 除(2)外 | D. | 全部 |
