题目内容
11.不同温度下,水溶液中H+的物质的量浓度和OH-的物质的量浓度的关系如图所示.下列说法不正确的是( )
| A. | M点和N点对应的溶液均呈中性 | |
| B. | T1℃时,P点对应溶液中,水电离出来的c(H+)可能为10-4mol•K-1或10-10mol•L-1 | |
| C. | T2℃时,pH=11的NaOH溶液与pH=1的稀H2SO4等体积混合,所得溶液的pH=6 | |
| D. | 向某溶液中加入酸或碱,均可以使该溶液从M点转化为N点 |
分析 水的Kw只与温度有关,温度相同时Kw相同,温度升高,促进水的电离,Kw增大,水的离子积只与温度有关,与溶液的类型无关,可能为纯水,也可能为酸、碱、盐溶液.由图象可知,M、P都为T1℃时的曲线上,M点c(H+)=c(OH-)=10-7mol•L-1,Kw=10-14,N点c(H+)=c(OH-)=10-6mol•L-1,Kw=10-12,以此解答该题.
解答 解:A.由图象可知,M点、N点都存在c(H+)=c(OH-),则溶液呈中性,故A正确;
B.T1℃时,P点对应溶液中,c(OH-)=10-4mol•L-1,如为盐溶液,则水电离出来的c(H+)可能为10-4mol•K-1,如为碱溶液,抑制水的电离,则水电离出来的c(H+)可能为10-10mol•L-1,故B正确;
C.T2℃时,Kw=10-12,pH=11的NaOH溶液与pH=1的稀H2SO4等体积混合,恰好完全反应,溶液呈中性,则所得溶液的pH=6,故C正确;
D.向某溶液中加入酸或碱,溶液温度不变,则Kw不变,不可以使该溶液从M点转化为N点,故D错误.
故选D.
点评 本题考查了水的电离及其影响,为高频考点,题目难度中等,注意合理分析图象,把握水的离子积只受温度的影响,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
16.区别二氧化硫气体和二氧化碳气体的方法最佳是( )
| A. | 通入澄清的石灰水 | B. | 根据有无毒性 | ||
| C. | 用湿润的蓝色石蕊试纸 | D. | 用品红溶液 |
14.两种气态烃组成的混合气体0.2mol,完全燃烧生成0.3ml CO2和7.2g水,下列说法正确的是( )
| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 一定没有甲烷 | D. | 可能有乙烷 |
6.有关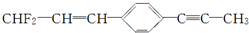 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )
 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )| A. | 该有机物物质的类别为:卤代烃、烯烃、炔烃 | |
| B. | 该有机物分子式:C12H9F2 | |
| C. | 最多有8个碳原子在同一直线上 | |
| D. | 12个碳原子有可能都在同一平面上 |
20.甲、乙两种溶液中分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH-这6种子中的3种(两种溶液中的离子不重复),已知甲溶液呈蓝色,则乙溶液中大量存在的离子是( )
| A. | Cu2+、H+、Cl- | B. | K+、CO32-、OH- | C. | Cl-、CO32-、OH- | D. | K+、H+、Cl- |
1.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA | |
| B. | 20g重水中含有的电子数为10NA | |
| C. | 常温下,5.6g铁与足量的盐酸反应,失去的电子数为0.3NA | |
| D. | 1L 0.1mol/L NH4Cl溶液中含NH4+数为0.1NA |