题目内容
14.两种气态烃组成的混合气体0.2mol,完全燃烧生成0.3ml CO2和7.2g水,下列说法正确的是( )| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 一定没有甲烷 | D. | 可能有乙烷 |
分析 两种气态烃组成的混合气体0.2mol,完全燃烧生成0.3ml CO2和7.2g水,n(H2O)=$\frac{7.2g}{18g/mol}$=0.4mol,结合C、H原子守恒确定烃的分子式,以此来解答.
解答 解:两种气态烃组成的混合气体0.2mol,完全燃烧生成0.3ml CO2和7.2g水,n(H2O)=$\frac{7.2g}{18g/mol}$=0.4mol,
平均分子组成中H原子数目为$\frac{0.4mol×2}{0.2mol}$=4,
平均分子组成中C原子数目为$\frac{0.3mol}{0.2mol}$=1.5,
故该混合烃的平均分子式为C1.5H4,
根据C原子可知,该烃一定含有CH4,另一种烃含有4个H原子,可能为乙烯、丙炔等,只有A符合,
故选A.
点评 本题考查有机物分子式的确定,为高频考点,把握平均组成及原子守恒法为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
2.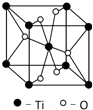 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
(1)下列叙述正确的是AD.(填字母)
A.HCHO与水分子间能形成氢键
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.苯分子中含有 6个σ键和1个大π键,苯是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
Mn元素价电子排布式为3d54s2,气态 Mn2+再失去一个电子比气态 Fe2+再失去一个电子难,其原因是由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少.
(3)铁原子核外有26种运动状态不同的电子.
(4)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于d区.
(5)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为TiO2.
(6)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被 NaClO氧化成N2和CO2.
①H、C、N、O四种元素的电负性由小到大的顺序为H<C<N<O
②与CNO-互为等电子体微粒的化学式为CO2或N2O或SCN-(写出一种即可).
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式N≡C-O-H.
 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.(1)下列叙述正确的是AD.(填字母)
A.HCHO与水分子间能形成氢键
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.苯分子中含有 6个σ键和1个大π键,苯是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
| 元素 | Mn | Fe | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(3)铁原子核外有26种运动状态不同的电子.
(4)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于d区.
(5)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为TiO2.
(6)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被 NaClO氧化成N2和CO2.
①H、C、N、O四种元素的电负性由小到大的顺序为H<C<N<O
②与CNO-互为等电子体微粒的化学式为CO2或N2O或SCN-(写出一种即可).
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式N≡C-O-H.
11.不同温度下,水溶液中H+的物质的量浓度和OH-的物质的量浓度的关系如图所示.下列说法不正确的是( )

| A. | M点和N点对应的溶液均呈中性 | |
| B. | T1℃时,P点对应溶液中,水电离出来的c(H+)可能为10-4mol•K-1或10-10mol•L-1 | |
| C. | T2℃时,pH=11的NaOH溶液与pH=1的稀H2SO4等体积混合,所得溶液的pH=6 | |
| D. | 向某溶液中加入酸或碱,均可以使该溶液从M点转化为N点 |
 碳、氮、氟、硅、钛等元素的化合物广泛应用于生产生活,回答下列问题:
碳、氮、氟、硅、钛等元素的化合物广泛应用于生产生活,回答下列问题: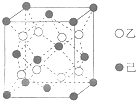 乙、丙、丁简单离子的核外电子排布相同,这三种元素按6:3:1的原子个数比可形成一种离子晶体W;丙与戊可形成常见离子晶体X,甲与己可形成常见离子晶体Y,且X和Y电子数相同.
乙、丙、丁简单离子的核外电子排布相同,这三种元素按6:3:1的原子个数比可形成一种离子晶体W;丙与戊可形成常见离子晶体X,甲与己可形成常见离子晶体Y,且X和Y电子数相同.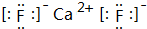 ;
;
 .
. .
. 有如图所示某有机物,根据该有机物的结构回答:
有如图所示某有机物,根据该有机物的结构回答: .
.