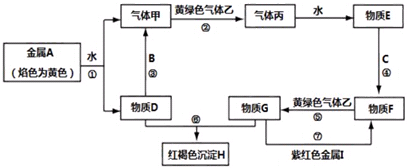
题目内容
12.下列化学键中键能最大的是( )| A. | F-H | B. | Cl-H | C. | Br-H | D. | I-H |
分析 非金属元素的非金属性越强,其氢化物越稳定,共价键的键能越大,据此分析.
解答 解:非金属元素的非金属性越强,其氢化物越稳定,共价键的键能越大,非金属性:F>Cl>Br>I,则H-F的键能最大;
故选A.
点评 本题考查了共价键极性强弱的判断和共价键强弱的比较,根据非金属元素非金属性强弱来分析解答即可,熟悉元素周期律即可解答,难度不大.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案
相关题目
17.由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是( )
| A. | NaN3与KN3结构类似,前者晶格能较小 | |
| B. | 第一电离能(I1):N>P>S | |
| C. | 钠晶胞结构属于体心结构,该晶胞分摊含2个钠原子 | |
| D. | 氮气常温下很稳定,是因为氮的电负性小 |
2.下列关于原电池的叙述中正确的是( )
| A. | 原电池是将化学能直接转变为电能的装置 | |
| B. | 原电池负极发生的电极反应是还原反应 | |
| C. | 原电池在工作时其正极不断产生电子并经外电路流向负极 | |
| D. | 原电池的电极只能由两种不同的金属构成 |
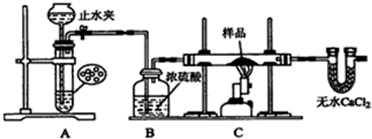
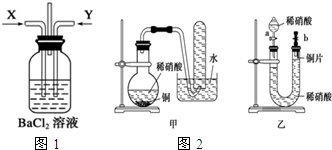 请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发生的有关问题.
请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发生的有关问题.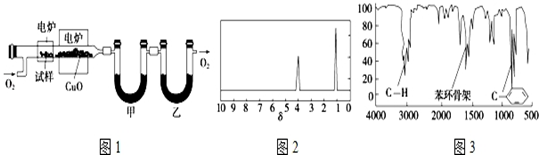
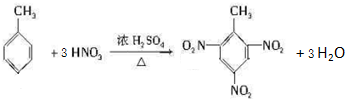 .
.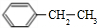 、
、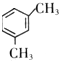 .
.