题目内容
工业废水中常含有一定量的Cr2O72-和Cr2O42-,它们会对人类及生态系统产生很大损害,必须进行处理,常用的处理方法有两种.
方法1:还原沉淀法
①转化
②还原
③沉淀
该法的工艺流程为 Cr2O42-
Cr2O72-
Cr3+
Cr(OH)3↓,其中第①步存在下列平衡:2Cr2O42-(黄色)+2H+?Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显 色.
(2)能说明第①步反应达平衡状态的是 .
a.Cr2O72-和Cr2O42-的浓度相同 b.2V(Cr2O72-)=V(Cr2O42-) c.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡
Cr(OH)3(s)?Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)?c3(OH-)=10-32
常温下,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 .
方法2电解法:
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(4)用Fe做电极的原因为 .
(5)在阴极附近溶液pH升高的原因(用电极反应式解释) ,溶液中同时生成的沉淀还有 .
方法1:还原沉淀法
①转化
②还原
③沉淀
该法的工艺流程为 Cr2O42-
| H+ |
| Fe2+ |
| OH- |
(1)若平衡体系的pH=2,该溶液显
(2)能说明第①步反应达平衡状态的是
a.Cr2O72-和Cr2O42-的浓度相同 b.2V(Cr2O72-)=V(Cr2O42-) c.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡
Cr(OH)3(s)?Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)?c3(OH-)=10-32
常温下,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
方法2电解法:
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(4)用Fe做电极的原因为
(5)在阴极附近溶液pH升高的原因(用电极反应式解释)
考点:"三废"处理与环境保护,化学平衡状态的判断,电解原理
专题:
分析:(1)根据外界条件对平衡的影响来确定平衡移动方向,从而确定离子浓度大小和溶液颜色变化;
(2)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡;
(3)根据溶度积常数以及水的离子积常数来进行计算;
(4)根据化学原理:铁失电子得到的亚铁离子和Cr2O72-的酸性废水反应,将+6价Cr元素还原为+3价;
(5)Fe为阳极,则阳极反应为Fe-2e-=Fe2+,溶液中氢离子在阴极放电生成氢气,则阴极反应为2H++2e-=H2 ↑,在阴极附近溶液pH升高溶液中的Fe3+也将转化为Fe(OH)3沉淀;
(2)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡;
(3)根据溶度积常数以及水的离子积常数来进行计算;
(4)根据化学原理:铁失电子得到的亚铁离子和Cr2O72-的酸性废水反应,将+6价Cr元素还原为+3价;
(5)Fe为阳极,则阳极反应为Fe-2e-=Fe2+,溶液中氢离子在阴极放电生成氢气,则阴极反应为2H++2e-=H2 ↑,在阴极附近溶液pH升高溶液中的Fe3+也将转化为Fe(OH)3沉淀;
解答:
解:(1)若平衡体系的pH=2,c(H+)增大,平衡2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O右移,溶液呈橙色,
故答案为:橙;
(2)a.平衡时Cr2O72-和Cr2O42-的浓度决定于反应前加入的多少,与是否平衡无关,故a错误;
b.2V(Cr2O72-)=V(Cr2O42-),正逆反应速率之比不等于化学计量数之比,反应未达到平衡状态,故b错误;
c.平衡时各物质的浓度不再改变,即溶液的颜色不再改变,故c正确;
故选:C;
(3)当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=
=10-9 mol/L,c(H+)═
=10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5,
故答案为:5;
(4)铁作阳极失电子得到的亚铁离子会和Cr2O72-的酸性废水反应,将+6价Cr元素还原为+3价,发生反应的离子方程式为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,
故答案为:提供Fe2+作还原剂;
(5)Fe为阳极,则阳极反应为Fe-2e-=Fe2+,在阴极附近溶液pH升高的原因是水电离产生的H+放电生成H2:2H++2e-═H2↑;同时大量产生了OH-,所以溶液中的Fe3+也将转化为Fe(OH)3沉淀,
故答案为:2H++2e-═H2↑;Fe(OH)3;
故答案为:橙;
(2)a.平衡时Cr2O72-和Cr2O42-的浓度决定于反应前加入的多少,与是否平衡无关,故a错误;
b.2V(Cr2O72-)=V(Cr2O42-),正逆反应速率之比不等于化学计量数之比,反应未达到平衡状态,故b错误;
c.平衡时各物质的浓度不再改变,即溶液的颜色不再改变,故c正确;
故选:C;
(3)当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=
| 3 |
| ||
| 10-14 |
| 10-9 |
故答案为:5;
(4)铁作阳极失电子得到的亚铁离子会和Cr2O72-的酸性废水反应,将+6价Cr元素还原为+3价,发生反应的离子方程式为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,
故答案为:提供Fe2+作还原剂;
(5)Fe为阳极,则阳极反应为Fe-2e-=Fe2+,在阴极附近溶液pH升高的原因是水电离产生的H+放电生成H2:2H++2e-═H2↑;同时大量产生了OH-,所以溶液中的Fe3+也将转化为Fe(OH)3沉淀,
故答案为:2H++2e-═H2↑;Fe(OH)3;
点评:本题主要考查了化学平衡移动原理、化学平衡状态判断、沉淀溶解平衡、电解原理及氧化还原反应等内容.解题根据题给信息,再结合相关原理可进行解答,题目难度中等.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
下列说法正确的是(NA代表阿伏伽德罗常数)( )
| A、18g D2O 含有的质子数目为10NA |
| B、含有53gNa2CO3的溶液中,含离子数目为1.5NA |
| C、将0.1molFeCl3 制成Fe(OH)3胶体,生成的胶体粒子数为0.1NA |
| D、常温常压下,4.6gNO2气体含有的原子数目为0.3NA |
下列叙述正确的是( )
| A、电解NaCl溶液时,阴极产生1mol Cl2的同时阳极产生1mol H2 |
| B、0.1mol?L-1 AlCl3溶液中Al3+的浓度为0.1mol?L-1 |
| C、7g 14C中所含中子数为4NA(设NA为阿伏加德罗常数的值) |
| D、2.24L氯气与足量NaOH稀溶液反应,转移0.1mol电子 |
下列除杂分离方法正确的是( )
| 选项 | 物质 | 杂质 | 所用试剂 | 分离方法 |
| A | 苯 | 苯酚 | 足量浓溴水 | 过滤 |
| B | CH3CH2OH | CH3COOH | 足量CaO | 蒸馏 |
| C | C2H5Br | Br2 | 足量Na2SO3(aq) | 分液 |
| D | KCl | CaCl2 | 足量Na2CO3溶液、盐酸 | 过滤 |
| A、A | B、B | C、C | D、D |
以下表述不符合元素周期律的是( )
| A、酸性:H3PO4>HNO3>HClO4 |
| B、热稳定性:HF>H2O>NH3 |
| C、离子半径:F->Na+>Mg2+ |
| D、还原性:HI>HBr>HCl |
12g镁在空气中点燃,完全反应后生成物质的质量( )
| A、大于20g | B、小于20g |
| C、等于20g | D、无法确定 |

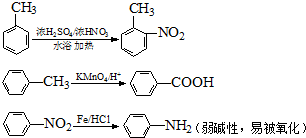
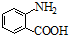 中官能团的名称
中官能团的名称 含苯环的同分异构体的结构简式
含苯环的同分异构体的结构简式
 分子中含有氯原子,按实验操作顺序,依次需要加入的试剂是
分子中含有氯原子,按实验操作顺序,依次需要加入的试剂是