题目内容
11.近年来全国各地长期被雾霾笼罩,雾霾颗粒中汽车尾气占20%以上.已知汽车尾气中的主要污染物为NOx、CO、超细颗粒(PM2.5)等有害物质.目前,已研究出了多种消除汽车尾气污染的方法.根据下列示意图回答有关问题:(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图1:
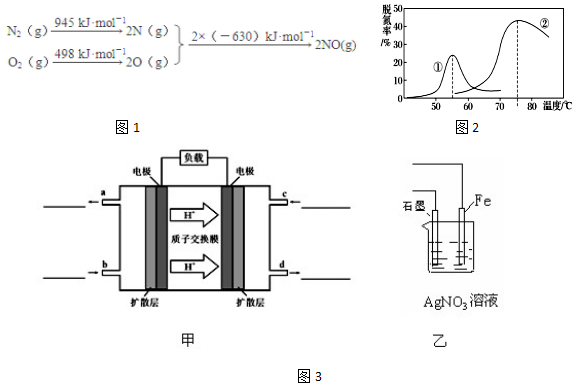
写出该反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=+183KJ/mol
(2)空燃比较易产生CO,有人提出可以设计反应2CO(g)═2C(s)+O2(g)来消除CO的污染.判断该设想是否可行,并说出理由:不合理,该反应焓增、熵减,任何条件下都不能自发进行或该反应△H>0,△S<0 则△G>0.
(3)在汽车上安装三元催化转化器可实现反应:
(Ⅱ)2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0.若该反应在恒压的密闭容器中进行,则下列有关说法正确的是C
A.其他条件不变,增大催化剂与反应物的接触面积,能提高反应速率,使平衡常数增大
B.平衡时,其他条件不变,升高温度,逆反应速率增大,正反应速率减小
C.在恒温条件下,混合气体的密度不变时,反应达到化学平衡状态
D.平衡时,其他条件不变,增大NO的浓度,反应物的转化率都增大
(4)将NO和CO以一定的流速通过两种不同的催化剂进行反应(Ⅱ),经过相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图2所示.以下说法正确的是C.
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.在该题条件下,两种催化剂分别适宜于55℃和75℃左右脱氮
(5)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理示意图如图3甲,
该燃料电池的电池反应式为 2CH3OH (g)+3O2(g)═2CO2(g)+4H2O(l)
①负极的电极反应式为,氧气从口通入c(填b或c)
②用该原电池电解AgNO3溶液,若Fe电极增重5.4g,则燃料电池在理论上消耗的氧气的体积为280mL(标准状况)
分析 (1)根据能量变化图计算反应热,反应热=反应物的键能和-生成物的键能和,从而书写热化学方程式;
(2)根据△H-T△H<0来判断反应的自发性;
(3)A.平衡常数是温度的函数,只与温度有关;
B.升高温度,化学反应速率加快;
C.这是一个气体体积变化的反应,密度不变相当于浓度不变;
D.增大NO的浓度,CO反应物的转化率增大,NO的转化率减小,得不偿失;
(4)A.催化剂只影响反应速率,不会改变转化率;
B.增大压强平衡向逆反应方向移动;
C.根据图象判断,脱氨率最高的点对应的温度应是最适宜温度;
(5)①燃料电池正极通氧气;
②根据转移电子守恒计算.
解答 解:(1)该反应中的反应热=反应物的键能和-生成物的键能和=(945+498)kJ/mol-2×630kJ/mol=+183kJ/mol,所以N2和O2反应生成NO的热化学反应方程式为N2(g)+O2(g)=2NO(g)△H=+183kJ•mol-1;
故答案为:N2(g)+O2(g)=2NO(g)△H=+183KJ/mol;
(2)2CO(g)=2C(s)+O2(g)(△H>0、△S<0)是一个焓增、熵减的反应,任何情况下不能自发进行,所以无法消除CO的污染,
故答案为:不合理,该反应焓增、熵减,任何条件下都不能自发进行或该反应△H>0,△S<0则△G>0;
(3)A.平衡常数是温度的函数,只与温度有关,故增大催化剂与反应物的接触面积,平衡常数不变,故A错误;
B.升高温度,化学反应速率加快,正,逆反应速率都增大,故B错误;
C.这是一个气体体积变化的反应,密度不变相当于浓度不变,故能说明反应达到化学平衡状态,故C正确;
D.增大NO的浓度,CO反应物的转化率增大,NO的转化率减小,得不偿失,故反应物的转化率都增大错误,故D正确;
故答案为:C;
(4)A.催化剂不会影响转化率,只影响反应速率,所以第②种催化剂和第①种催化剂对转化率没有影响,故A错误;
B.反应为体积增大的反应,增大压强平衡向逆反应方向移动,脱氮率减小,故B错误;
C.两种催化剂分别在55℃和75℃左右催化效率最高,说明此时催化剂的活性最大,故C正确;
故答案为:C;
(5)①燃料电池正极通氧气,故氧气从口通入c,故答案为:c;
②Fe电极增重5.4g,说明析出银是5.4g,则转移电子是5.4g÷108g/mol=0.05mol,所以根据电子得失守恒可知,消耗氧气是0.05mol÷4=0.0125mol,体积是0.0125mol×22.4L/mol=0.28L=280ml,故答案为:280.
点评 本题考查化学反应速率与化学平衡移动问题,化学平衡常数及影响因素,以及燃料电池,明确燃料电池中正负极上得失电子是解(5)题关键,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 标准状况下,4.48 L重水(D2O)中含有的中子数为2NA | |
| B. | 0.1mol乙烯和乙醇(C2H5OH,蒸汽)混合物完全燃烧所消耗的氧分子数一定为0.3NA | |
| C. | 常温常压下,15g乙烷分子中含有的共价键数目为3NA | |
| D. | 273K,101kPa下,14g乙烯与丙烯混合物中含有碳原子数目为3NA |
| 元素 | 结构及性质 |
| A | A单质是生活中的常见金属,它有两种氯化物,相对分子质量相差35.5 |
| B | B原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| C | C是常见化肥的主要元素,单质常温下呈气态 |
| D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| E | 通常情况下,E没有最高正化合价,其单质之一是空气的一种主要成分 |
| F | F是周期表中元素原子半径最小的,其单质常温下是密度最小的气体 |
(2)B与C形成的化合物的化学式为Mg3N2,它属于离子(填“离子”或“共价”)化合物.
(3)①F与E可以形成原子个数比分别为2:1、1:1的两种化合物X和Y,A的一种氯化物能加速Y的分解,写出该过程的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的水溶液显碱性,N的结构式为
 .
.(4)B~F各元素原子半径由小到大的顺序是Mg>Si>N>O>H (用元素符号表示).
(5A的两种氯化物相互转化的离子方程式:2FeCl2+Cl2=2FeCl3、Fe+2FeCl3=3FeCl2.
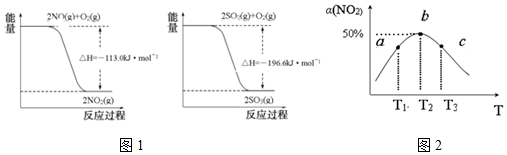
(1)已知:写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式SO2(g)+NO2(g)=SO3(g)+NO(g)△H=-41.8kJ/mol.
(2)向容积为1L密闭容器中分别充入0.10mol NO2和0.15mol SO2,在不同温度下测定同一时刻NO2的转化率,结果如图1所示.
①如图2a、c两点反应速率大小关系:υ(a)<υ(c).(填“>”、“<”或“=”)
②温度为T2时从反应开始经过2min达到b点,用SO3表示这段时间的反应速率为0.025mol•L-1•min-1,此温度下该反应的平衡常数为0.5,若在此温度下,保持容器的容积不变,再向容器中充入0.20mol NO2和0.30mol SO2,NO2的转化率不变.(填“增大”、“减小”或“不变”)
③NO2的转化率随温度升高先增大后减小的原因是:温度为T2,b点为平衡点,T2以前温度升高,反应速率加快,NO2转化率增大,T2以后,该反应为放热反应,升高温度,平衡向逆反应方向移动,转化率减小.
(3)常温下用NaOH溶液吸收SO2,在吸收过程中,溶液pH随n(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为4~7之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一,写出该阴极的电极反应式2HSO3-+2H++2e-=S2O42-+2H2O.
 1915年诺贝尔物理学奖授予HenryBragg和LawrenceBragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
1915年诺贝尔物理学奖授予HenryBragg和LawrenceBragg,以表彰他们用X射线对晶体结构的分析所作的贡献.(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如表:
| 晶体 | NaCl | KC1 | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |
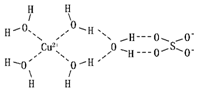
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均采用虚线表示.
①实验证明,用蒸汽密度法测得的H2O的相对分子质量比用化学式计算出来的相对分子质量要大,原因是水分子间存在氢键,氢键会使水分子成为缔合水分子,所以计算出来的相对分子质量较大.
②SO42-中S原子的杂化类型是sp3,与其互为等电子体的离子有ClO4-、PO43-(任写两种)
③已知[Cu( NH3)4]2+具有对称的空间构型,[Cu( NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,用[Cu(NH3)4]2+的空间构型为平面正方形
④写出基态Cu2+的外围电子排布式3d9;金属钢采用面心立方堆积方式,已知Cu原子的半径为r pm,NA表示阿伏加徳罗常数,金属铜的密度是$\frac{4×64}{{N}_{A}(2\sqrt{2}r×1{0}^{-10})^{3}}$ g/cm3(列出计算式).
| A. | pH=10的CH3COONa溶液中,水电离产生的c(OH-)=1×10-10mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍(溶液体积变为原来10倍)后,其pH=b,则a<b+1 | |
| C. | pH=3的H2S溶液与pH=11的NaOH溶液任意比例混合:C(Na+)+c(H+)=c(OH-)+c(HS-) | |
| D. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的:c(Na+)大小顺序为①<②<③ |
 有机酸种类繁多,广泛分布于中草葯的叶、根、特别是果实中,是有机合成、工农业生产的重要原料,请回答下列有关问题:
有机酸种类繁多,广泛分布于中草葯的叶、根、特别是果实中,是有机合成、工农业生产的重要原料,请回答下列有关问题: