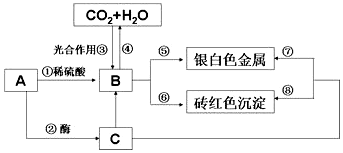
题目内容
12.已知在常温常压下:①2CH3OH(l)+2O2(g)═2CO(g)+4H2O(g)△H=-a kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-b kJ•mol-1
③H2O(g)═H2O(l)△H=-c kJ•mol-1
则表示CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-$\frac{1}{2}$(a+b+4c)kJ•mol-1.
分析 分析目标方程式与已知方程式,始终抓住目标反应和已知反应之间的关系应用数学知识由已知方程式推得目标方程式,依据盖斯定律计算解答.
解答 解:已知在常温常压下:
①2CH3OH(l)+2O2(g)═2CO(g)+4H2O(g)△H=-a kJ•mol-1;
②2CO(g)+O2(g)═2CO2(g)△H=-b kJ•mol-1;
③H2O(g)═H2O(l)△H=-c kJ•mol-1;
$\frac{1}{2}(①+②+4×③)$得:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l),依据盖斯定律得:△H=-$\frac{1}{2}$(a+b+4c)kJ•mol-1;
所以CH3OH(l)燃烧热的热化学方程式为依据盖斯定律得CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-$\frac{1}{2}$(a+b+4c)kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-$\frac{1}{2}$(a+b+4c)kJ•mol-1.
点评 本题考查了燃烧热的热化学方程式的书写,明确盖斯定律计算反应热的方法,熟悉燃烧热的概念是解题关键,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
2.部分中学化学常见元素原子结构及性质如表所示:
(1)A元素基态原子的外围电子排布式为3d64s2.第一电离能的大小关系:C>E(用>或<表示).
(2)B与C形成的化合物的化学式为Mg3N2,它属于离子(填“离子”或“共价”)化合物.
(3)①F与E可以形成原子个数比分别为2:1、1:1的两种化合物X和Y,A的一种氯化物能加速Y的分解,写出该过程的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的水溶液显碱性,N的结构式为 .
.
(4)B~F各元素原子半径由小到大的顺序是Mg>Si>N>O>H (用元素符号表示).
(5A的两种氯化物相互转化的离子方程式:2FeCl2+Cl2=2FeCl3、Fe+2FeCl3=3FeCl2.
| 元素 | 结构及性质 |
| A | A单质是生活中的常见金属,它有两种氯化物,相对分子质量相差35.5 |
| B | B原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| C | C是常见化肥的主要元素,单质常温下呈气态 |
| D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| E | 通常情况下,E没有最高正化合价,其单质之一是空气的一种主要成分 |
| F | F是周期表中元素原子半径最小的,其单质常温下是密度最小的气体 |
(2)B与C形成的化合物的化学式为Mg3N2,它属于离子(填“离子”或“共价”)化合物.
(3)①F与E可以形成原子个数比分别为2:1、1:1的两种化合物X和Y,A的一种氯化物能加速Y的分解,写出该过程的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的水溶液显碱性,N的结构式为
 .
.(4)B~F各元素原子半径由小到大的顺序是Mg>Si>N>O>H (用元素符号表示).
(5A的两种氯化物相互转化的离子方程式:2FeCl2+Cl2=2FeCl3、Fe+2FeCl3=3FeCl2.
3. 1915年诺贝尔物理学奖授予HenryBragg和LawrenceBragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
1915年诺贝尔物理学奖授予HenryBragg和LawrenceBragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如表:
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是MgO>CaO>NaCl>KCl,Na原子核外有4 种不同的能级.
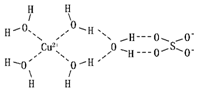
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均采用虚线表示.
①实验证明,用蒸汽密度法测得的H2O的相对分子质量比用化学式计算出来的相对分子质量要大,原因是水分子间存在氢键,氢键会使水分子成为缔合水分子,所以计算出来的相对分子质量较大.
②SO42-中S原子的杂化类型是sp3,与其互为等电子体的离子有ClO4-、PO43-(任写两种)
③已知[Cu( NH3)4]2+具有对称的空间构型,[Cu( NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,用[Cu(NH3)4]2+的空间构型为平面正方形
④写出基态Cu2+的外围电子排布式3d9;金属钢采用面心立方堆积方式,已知Cu原子的半径为r pm,NA表示阿伏加徳罗常数,金属铜的密度是$\frac{4×64}{{N}_{A}(2\sqrt{2}r×1{0}^{-10})^{3}}$ g/cm3(列出计算式).
 1915年诺贝尔物理学奖授予HenryBragg和LawrenceBragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
1915年诺贝尔物理学奖授予HenryBragg和LawrenceBragg,以表彰他们用X射线对晶体结构的分析所作的贡献.(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如表:
| 晶体 | NaCl | KC1 | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均采用虚线表示.
①实验证明,用蒸汽密度法测得的H2O的相对分子质量比用化学式计算出来的相对分子质量要大,原因是水分子间存在氢键,氢键会使水分子成为缔合水分子,所以计算出来的相对分子质量较大.
②SO42-中S原子的杂化类型是sp3,与其互为等电子体的离子有ClO4-、PO43-(任写两种)
③已知[Cu( NH3)4]2+具有对称的空间构型,[Cu( NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,用[Cu(NH3)4]2+的空间构型为平面正方形
④写出基态Cu2+的外围电子排布式3d9;金属钢采用面心立方堆积方式,已知Cu原子的半径为r pm,NA表示阿伏加徳罗常数,金属铜的密度是$\frac{4×64}{{N}_{A}(2\sqrt{2}r×1{0}^{-10})^{3}}$ g/cm3(列出计算式).
20.常温下,下列说法正确的是( )
| A. | pH=10的CH3COONa溶液中,水电离产生的c(OH-)=1×10-10mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍(溶液体积变为原来10倍)后,其pH=b,则a<b+1 | |
| C. | pH=3的H2S溶液与pH=11的NaOH溶液任意比例混合:C(Na+)+c(H+)=c(OH-)+c(HS-) | |
| D. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的:c(Na+)大小顺序为①<②<③ |
7.下列各项中描述一和描述二都正确的是( )
| 描述一 | 描述二 | |
| A | 淀粉和纤维素互为同分异构体 | 乙酸和乙酸乙酯互为同系物 |
| B | 金刚石和石墨互为同素异形体 | O2和O3互为同位素 |
| C | SO2和NO2都属于大气污染物 | pH小于7的雨水就属于酸雨 |
| D | 正反应活化能小于逆反应活化能的反应属于放热反应 | 反应物能量总和大于生成物能量总和的反应属于放热反应 |
| A. | A | B. | B | C. | C | D. | D |
17.有一种有机化合物,其结构简式如图,下列有关它的性质的叙述,正确的是( )

| A. | 有弱酸性,1mol该有机物与溴水反应,最多能消耗4mol Br2 | |
| B. | 在一定条件下,1mol该物质最多能与7mol NaOH完全反应 | |
| C. | 在Ni催化下,1mol该物质可以和8mol H2发生加成反应 | |
| D. | 它能发生水解反应,水解后只能生成两种产物 |
4. 苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
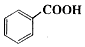 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$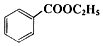 +H2O
+H2O
已知:
*苯甲酸在100℃会迅速升华.实验步骤如下:
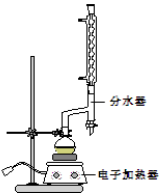
①在圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、20mL 环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按如图所示装好仪器,控制温度在65〜70℃加热回流2h.反应时环己烷一乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来,再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇.
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞.继续加热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒人盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性.
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层.加入氯化钙,对粗产物进行蒸馏(装置如图所示),低温蒸出乙醚后,继续升温,接收210〜213℃的馏分.
⑤检验合格,测得产品体积为13.16mL.
(1)在该实验中,圆底烧瓶的容积最适合的是C(填入正确选项前的字母).
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中沸石的作用是防爆沸,使用分水器不断分离除去水的目的是使平衡不断地向正向移动.
(3)骤②中应控制馏分的温度在C.°
A.215〜220℃B.85〜90℃C.78〜80℃D.65〜70℃
(4)步骤③加入Na2CO3的作用是除去苯甲酸乙酯中的苯甲酸;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是在苯甲酸乙酯中有未除净的苯甲酸,受热至100℃时升华.
(5)关于步骤④中的萃取分液操作叙述正确的是AD
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗下口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为92.12%.
 苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为: +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O已知:
| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸* | 无色片状晶休 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
①在圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、20mL 环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按如图所示装好仪器,控制温度在65〜70℃加热回流2h.反应时环己烷一乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来,再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇.
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞.继续加热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒人盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性.
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层.加入氯化钙,对粗产物进行蒸馏(装置如图所示),低温蒸出乙醚后,继续升温,接收210〜213℃的馏分.
⑤检验合格,测得产品体积为13.16mL.
(1)在该实验中,圆底烧瓶的容积最适合的是C(填入正确选项前的字母).
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中沸石的作用是防爆沸,使用分水器不断分离除去水的目的是使平衡不断地向正向移动.
(3)骤②中应控制馏分的温度在C.°
A.215〜220℃B.85〜90℃C.78〜80℃D.65〜70℃
(4)步骤③加入Na2CO3的作用是除去苯甲酸乙酯中的苯甲酸;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是在苯甲酸乙酯中有未除净的苯甲酸,受热至100℃时升华.
(5)关于步骤④中的萃取分液操作叙述正确的是AD
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗下口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为92.12%.