题目内容
20.下列叙述正确的是( )| A. | 同周期元素的原子半径以ⅦA族的为最大 | |
| B. | 短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素 | |
| C. | 同主族两种元素原子的核外电子数的差值可能为26 | |
| D. | 科学家在周期表中金属元素与非金属元素分界线处找到了优良的催化剂 |
分析 A、同周期的元素的原子半径随着原子序数的增大,而逐渐减小;
B、短周期元素中次外层电子数是最外层电子数2倍的元素的有Li、Si等元素;
C、第ⅤⅡA的氟的核外电子数是9与溴的核外电子数是35;
D、在金属元素与非金属性元素附近的元素既有金属性又有非金属性.
解答 解:A、同周期的元素的原子半径随着原子序数的增大,而逐渐减小,故A错误;
B、短周期中次外层电子数是最外层电子数两倍的元素可能是硅元素也可能是锂元素,故B错误;
C、原子的原子序数等于核外电子数,每周期中含有的元素种类数分别为:2、8、8、18、18、32种元素,因此同主族相间的两种元素之间原子序数相差36存在,如第ⅤⅡA的氟与溴的原子核外电子数的差值为26,故C正确;
D、在金属元素与非金属性元素附近的元素既有金属性又有非金属性,所以可以作为半导体材料,而在过度元素区可以找到催化剂,故D错误;
故选C.
点评 本题考查了同周期元素原子半径大小、同主族元素原子序数关系、最外层核外电子数和此外层电子数的关系,判断元素的种类、以及元素周期律的应用等知识点.

练习册系列答案
相关题目
10.下列表述错误的是( )
| A. | 氢氧根离子的电子式是: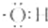 | B. | 甲烷分子的比例模型是: | ||
| C. | 硝基的表示方法-NO2 | D. | 饱和烃的通式是CnH2n+2(n≥1) |
11.下列实验操作中正确的是( )
| A. | 苯的硝化反应中,向浓硫酸中加浓硝酸制得混合酸 | |
| B. | 向稀氨水中逐渐加入硝酸银溶液来配制银氨溶液 | |
| C. | 向相对过量的氢氧化钠溶液中滴入少量硫酸铜溶液以配制新制氢氧化铜 | |
| D. | 溴乙烷在氢氧化钠溶液的存在下进行水解后,加入硝酸银溶液,可检验溴离子的存在 |
8.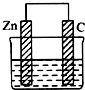 一个由锌片和石墨棒作为电极的原电池如图所示,电极反应分别是:
一个由锌片和石墨棒作为电极的原电池如图所示,电极反应分别是:
锌片:2Zn-4e-+4OH-═2ZnO+2H2O
石墨:2H2O+O2+4e-═4OH-
下列说法中不正确的是( )
 一个由锌片和石墨棒作为电极的原电池如图所示,电极反应分别是:
一个由锌片和石墨棒作为电极的原电池如图所示,电极反应分别是:锌片:2Zn-4e-+4OH-═2ZnO+2H2O
石墨:2H2O+O2+4e-═4OH-
下列说法中不正确的是( )
| A. | 电子从石墨经外电路流向锌片,电解质溶液为酸性溶液 | |
| B. | 锌片是负极,石墨是正极 | |
| C. | 电池总反应为2Zn+O2═2ZnO | |
| D. | 该原电池工作一段时间后石墨附近溶液中的c(OH-)增大 |
15.一定条件下,可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol•L-1、0.3mol•L-1、0.08mol•L-1,则下列判断正确的是( )
| A. | c1:c2的值不能确定 | |
| B. | 平衡时,Y和Z的生成速率之比为1:1 | |
| C. | 0.48mol•L-1<c1+c2+c3<0.56mol•L-1 | |
| D. | c1的取值范围为0<c1<0.14 mol•L-1 |
5.下列分子中所有原子都满足最外层8电子结构的是( )
| A. | NH3 | B. | PCl5 | C. | CO2 | D. | CO(NH2)2 |
12.将如图所示实验装置的K闭合,下列判断正确的是( )
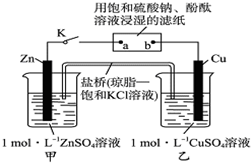

| A. | 电子沿Zn→a→b→Cu路径流动 | B. | Cu电极上发生氧化反应 | ||
| C. | 片刻后可观察到滤纸a点变红色 | D. | 片刻后甲池中c(SO42-)增大 |
10.38.4g铜和适量的浓硝酸反应,铜全部反应后,共收集到22.4L(标准状况下)NO和NO2混合气体,反应消耗的硝酸可能是( )
| A. | 1.0mol | B. | 1.6mol | C. | 2.2mol | D. | 2.4mol |



