��Ŀ����
2����֪����Cl2ͨ������KOH��Һ�������п�����KCl��KClO��KClO3����$\frac{c��C{l}^{-}��}{c��Cl{O}^{-}��}$��ֵ���¶ȸߵ��йأ���n��KOH��=a molʱ�������й�˵��������ǣ�������| A�� | ��ij�¶��£���Ӧ��$\frac{c��C{l}^{-}��}{c��Cl{O}^{-}��}$=11������Һ��$\frac{c��Cl{O}^{-}��}{c��Cl{O}_{3}^{-}��}$=$\frac{1}{2}$ | |
| B�� | �μӷ�Ӧ�����������ʵ�������$\frac{1}{2}$ a mol | |
| C�� | �ı��¶ȣ���Ӧ��ת�Ƶ��ӵ����ʵ���ne�ķ�Χ��$\frac{1}{2}$ a mol��ne��$\frac{5}{6}$ a mol | |
| D�� | �ı��¶ȣ�������KClO3��������۲���Ϊ$\frac{1}{7}$a mol |
���� A����n��ClO-��=1mol����n��Cl-��=11mol�����ݵ���ת���غ����n��ClO3-����
B����Clԭ���غ��֪��2n��Cl2��=n��KCl��+n��KClO��+n��KClO3�����ɼ������غ��֪n��KCl��+n��KClO��+n��KClO3��=n��KOH������������μӷ�Ӧ���������ʵ�����
C����������ֻ��KClO3ʱ��ת�Ƶ�����࣬���ݵ���ת���غ�n��KCl��=5��KClO3�����ɼ������غ㣺n��KCl��+n��KClO3��=n��KOH������������ֻ��KClOʱ��ת�Ƶ������٣����ݵ���ת���غ�n��KCl��=n��KClO�������ݼ������غ㣺n��KCl��+n��KClO��=n��KOH������������ת�Ƶ������ʵ�����Χ��
D����������ֻ��KClO3ʱ�������ʵ�������ɼ������غ㣺n��KCl��+n��KClO3��=n��KOH������ϵ���ת���غ���㣮
��� �⣺A����n��ClO-��=1mol����Ӧ��C��Cl-����C��ClO-��=11����n��Cl-��=11mol������ת���غ㣬5��n��ClO3-��+1��n��ClO-��=1��n��Cl-������5��n��ClO3-��+1��1mol=1��11mol�����n��ClO3-��=2mol������Һ��$\frac{c��Cl{O}^{-}��}{c��Cl{O}_{3}^{-}��}$=$\frac{1}{2}$����A��ȷ��
B����Clԭ���غ��֪��2n��Cl2��=n��KCl��+n��KClO��+n��KClO3�����ɼ������غ��֪n��KCl��+n��KClO��+n��KClO3��=n��KOH�����ʲμӷ�Ӧ�����������ʵ���=$\frac{1}{2}$n��KOH��=0.5amol����B��ȷ��
C����������ֻ��KClO3ʱ��ת�Ƶ�����࣬���ݵ���ת���غ�n��KCl��=5��KClO3�����ɼ������غ㣺n��KCl��+n��KClO3��=n��KOH������n��KClO3��=$\frac{1}{6}$n��KOH��=$\frac{1}{6}$a mol��ת�Ƶ���������ʵ���Ϊ��$\frac{1}{6}$a mol��5=$\frac{5}{6}$a mol����������ֻ��KClOʱ��ת�Ƶ������٣����ݵ���ת���غ�n��KCl��=n��KClO�������ݼ������غ㣺n��KCl��+n��KClO��=n��KOH�����ʣ�n��KClO��=$\frac{1}{2}$n��KOH��=$\frac{1}{2}$a mol��ת�Ƶ�����С���ʵ���=$\frac{1}{2}$a mol��1=$\frac{1}{2}$a mol����Ӧ��ת�Ƶ��ӵ����ʵ���ne�ķ�ΧΪ��$\frac{1}{2}$a mol��ne��$\frac{5}{6}$a mol����C��ȷ��
D����������ֻ��KClO3ʱ�������ʵ�������ݵ���ת���غ�n��KCl��=5��KClO3�����ɼ������غ㣺n��KCl��+n��KClO3��=n��KOH������n�����KClO3��=$\frac{1}{6}$n��KOH��=$\frac{1}{6}$a mol����D����
��ѡ��D��
���� ���⿼��������ԭ��Ӧ���㣬�Ѷ��еȣ�ע�����ת���غ㼰������Ӧ�ã����ؿ���ѧ���Ի���֪ʶ��Ӧ�������ͷ���������������

 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д�| A�� | 39K+��40Ca2+���еĵ������������������ | |
| B�� | D2��He��ͬ��ͬѹʱ���������ȣ���������� | |
| C�� | ͬһԪ�صĸ���ͬλ�ص��������ʡ���ѧ���ʾ�����ͬ | |
| D�� | �����������͵���������ȵ�����һ����ͬ��Ԫ�� |
 ʵ������H2O2�ֽⷴӦ��ȡ����ʱ������������Լӿ췴Ӧ���ʣ�ij�о���ѧϰС��Ϊ�о�����FeCl3������O2�������ʵ�Ӱ�죬�������������ʵ�鷽�������±������������������Լ���һ�������Ϻ���з�Ӧ��
ʵ������H2O2�ֽⷴӦ��ȡ����ʱ������������Լӿ췴Ӧ���ʣ�ij�о���ѧϰС��Ϊ�о�����FeCl3������O2�������ʵ�Ӱ�죬�������������ʵ�鷽�������±������������������Լ���һ�������Ϻ���з�Ӧ��| ʵ���� �Լ� | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/mL | 0 | 5.0 | 10.0 |
| H2O/mL | V3 | V4 | 0 |
��1��������ͼװ�����Ƚϸ÷�Ӧ�ķ�Ӧ���ʿ�������μ��װ�������ԣ���ע����������������һ�Σ���һ�������ص�ԭλ��˵�����������ã�
��2������Ӧ���Ũ�ȡ�����������Ӱ�����ʵ�����ȷ��֮����ͨ������ͬʱ�����ռ�������������ռ���ͬ�����������Ҫ��ʱ����㷴Ӧ���ʣ�
��3��Ϊʵ��ʵ��Ŀ�ģ���V1=20.0��V2=20.0��V3=10.0��V4=5.0��
��4�������������յ�֪ʶ�жϣ�������ʵ���з�Ӧ�������Ŀ�����C���ʵ���š���
��5����֪Fe3+��H2O2�ֽ�Ļ����ɷ�������Ӧ���У����е�һ����ӦΪ��2Fe3++H2O2�T2Fe2++O2��+2H+����ڶ�����Ӧ�����ӷ���ʽΪ��2Fe2++H2O2+2H+�T2Fe3++2H2O��
| A�� | ���������ӵĵ���ʽ�ǣ�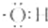 | B�� | ������ӵı���ģ���ǣ� | ||
| C�� | �����ı�ʾ����-NO2 | D�� | ��������ͨʽ��CnH2n+2��n��1�� |
| A�� | ����װ�����������ȡ������ͬ | |
| B�� | �����ü�ʯ�Ҹ��ﰱ�� | |
| C�� | �������ú��������ȡ����һ�� | |
| D�� | ���������ķ����ǽ�ʪ��ĺ�ɫʯ����ֽ���ڼ���ƿ���� |
| A�� | ����ʯ�����ᷴӦ��CO32-+2H+=H2O+CO2�� | |
| B�� | ��NH4HCO3��Һ�мӹ�����NaOH��Һ�����ȣ�NH4++OH-$\frac{\underline{\;\;��\;\;}}{\;}$NH3��+H2O | |
| C�� | ������SO2ͨ���䰱ˮ�У�SO2+NH3•H2O=HSO3-+NH4+ | |
| D�� | ��ϡ����ϴ���Թ��ڱڵ�������Ag+2H++NO3-=Ag++NO��+H2O |
| A�� | ����������Ӧ�У���Ũ�����м�Ũ�����Ƶû���� | |
| B�� | ��ϡ��ˮ��������������Һ������������Һ | |
| C�� | ����Թ���������������Һ�е�����������ͭ��Һ����������������ͭ | |
| D�� | ������������������Һ�Ĵ����½���ˮ�������������Һ���ɼ��������ӵĴ��� |
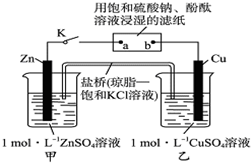
| A�� | ������Zn��a��b��Cu·������ | B�� | Cu�缫�Ϸ���������Ӧ | ||
| C�� | Ƭ�̺�ɹ۲쵽��ֽa����ɫ | D�� | Ƭ�̺�׳���c��SO42-������ |
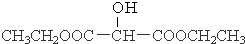 ��
��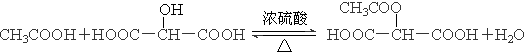 ��
��
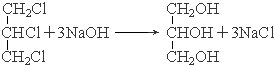 ��
��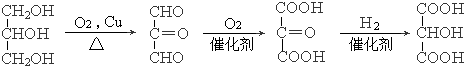 ��
��