题目内容
对于100mL 1mol/L盐酸与铁片的反应,采取下列措施能使反应速率加快的是: ,
①升高温度;
②改用100mL 3mol/L盐酸;
③多用300mL 1mol/L盐酸;
④用等量铁粉代替铁片;
⑤改用98%的硫酸.
①升高温度;
②改用100mL 3mol/L盐酸;
③多用300mL 1mol/L盐酸;
④用等量铁粉代替铁片;
⑤改用98%的硫酸.
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:若要加快产生氢气的速率,可增大反应的浓度、增大固体的表面积、升高温度以及形成原电池反应,注意加入浓硫酸的性质,以此解答该题.
解答:
解:①适当升高温度,增大活化分子百分数,反应速率加快,故正确;
②改用100mL 3mol/L盐酸,酸的浓度增大,反应速率加快,故正确;
③多用300mL 1mol/L盐酸,酸的浓度不变,反应速率不变,故错误;
④用等量铁粉代替铁片,增大固体接触面积,使反应速率加快,故正确;
⑤改用98%的硫酸,浓硫酸与铁不生成氢气,则不能加快反应速率,故错误;
综上所述,①②④正确;
故答案为:①②④.
②改用100mL 3mol/L盐酸,酸的浓度增大,反应速率加快,故正确;
③多用300mL 1mol/L盐酸,酸的浓度不变,反应速率不变,故错误;
④用等量铁粉代替铁片,增大固体接触面积,使反应速率加快,故正确;
⑤改用98%的硫酸,浓硫酸与铁不生成氢气,则不能加快反应速率,故错误;
综上所述,①②④正确;
故答案为:①②④.
点评:本题考查化学反应速率的影响因素,为高考高频考点,侧重于学生的分析能力和基本理论知识的综合运用的考查,难度不大,注意相关基础知识的积累,把握影响化学反应速率的因素

练习册系列答案
相关题目
用铜锌合金制成的黄铜制品常被误作黄金.下列方法不能区分其真伪的是( )
| A、观察外表 | B、放入硝酸中 |
| C、测定密度 | D、放入盐酸中 |
室温时,0.1mol?L-1的HA溶液的pH=3,向该溶液中逐滴加入NaOH,在滴加过程中,有关叙述正确的是( )
| A、原HA溶液中,c(H+)=c(OH-)+c(A-) |
| B、当滴入少量的NaOH,促进了HA的电离,溶液的pH增大 |
| C、当恰好完全中和时,溶液呈中性 |
| D、当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) |
下列说法一定正确的是( )
| A、一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
| B、对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
| C、将FeCl3溶液加热蒸干,可得到FeCl3固体 |
| D、0.10mol/L Al2(SO4)3溶液中Al3+数小于0.2NA(NA代表阿伏加德罗常数) |
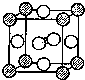 X、Y、D、E、M、N是原子序数依次增大的前四周期元素,其中X是周期表中原子半径最小的元素,Y元素基态原子的三个能级上电子数目相同,E是地壳中含量最多的元素,M是制常见不锈钢材料的第一主要合金元素,其基态原子核外的未成对电子数在同周期元素中最多,N是目前用量最大的金属元素.
X、Y、D、E、M、N是原子序数依次增大的前四周期元素,其中X是周期表中原子半径最小的元素,Y元素基态原子的三个能级上电子数目相同,E是地壳中含量最多的元素,M是制常见不锈钢材料的第一主要合金元素,其基态原子核外的未成对电子数在同周期元素中最多,N是目前用量最大的金属元素. 表示,镍原子用
表示,镍原子用 表示,镁原子用
表示,镁原子用 表示),则该晶体的化学式:
表示),则该晶体的化学式: 已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d亚层为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d亚层为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):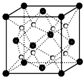 (1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.