题目内容
实验室用浓盐酸与二氧化锰制氯气,在标准情况下得到氯气448mL,求被氧化的HCl的物质的量.
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:根据n=
计算Cl2的物质的量,被氧化的HCl生成Cl2,根据反应方程式可知,被氧化的HCl的物质的量是参加反应的盐酸量的一半.
| V |
| Vm |
解答:
解:解:(1)标准状况下448mLCl2的物质的量为:
=0.02mol,则:
MnO2+4HCl═MnCl2+Cl2↑+2H2O
4 1
n(HCl) 0.02mol
故n(HCl)=0.02mol×4=0.08mol
被氧化的HCl生成Cl2,被氧化的HCl的物质的量是参加反应的盐酸量的一半,故被氧化的HCl为0.04mol,
答:被氧化的HCl的物质的量是0.04mol.
| 0.448L |
| 22.4L/mol |
MnO2+4HCl═MnCl2+Cl2↑+2H2O
4 1
n(HCl) 0.02mol
故n(HCl)=0.02mol×4=0.08mol
被氧化的HCl生成Cl2,被氧化的HCl的物质的量是参加反应的盐酸量的一半,故被氧化的HCl为0.04mol,
答:被氧化的HCl的物质的量是0.04mol.
点评:本题考查根据方程式的有关计算等,比较基础,注意反应中HCl起酸性、还原剂作用,各占一半.

练习册系列答案
相关题目
下列叙述错误的是( )
| A、钠与氧气在常温下反应生成氧化钠 |
| B、将钠置于干燥的氧气中充分反应,可能有过氧化钠生成 |
| C、钠易与氧气反应,但不能跟其他非金属反应 |
| D、将钠置于空气中一段时间,可能有碳酸钠生成 |
室温时,0.1mol?L-1的HA溶液的pH=3,向该溶液中逐滴加入NaOH,在滴加过程中,有关叙述正确的是( )
| A、原HA溶液中,c(H+)=c(OH-)+c(A-) |
| B、当滴入少量的NaOH,促进了HA的电离,溶液的pH增大 |
| C、当恰好完全中和时,溶液呈中性 |
| D、当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) |
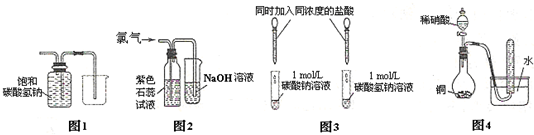
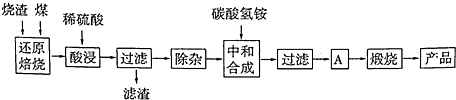
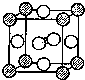 X、Y、D、E、M、N是原子序数依次增大的前四周期元素,其中X是周期表中原子半径最小的元素,Y元素基态原子的三个能级上电子数目相同,E是地壳中含量最多的元素,M是制常见不锈钢材料的第一主要合金元素,其基态原子核外的未成对电子数在同周期元素中最多,N是目前用量最大的金属元素.
X、Y、D、E、M、N是原子序数依次增大的前四周期元素,其中X是周期表中原子半径最小的元素,Y元素基态原子的三个能级上电子数目相同,E是地壳中含量最多的元素,M是制常见不锈钢材料的第一主要合金元素,其基态原子核外的未成对电子数在同周期元素中最多,N是目前用量最大的金属元素. 表示,镍原子用
表示,镍原子用 表示,镁原子用
表示,镁原子用 表示),则该晶体的化学式:
表示),则该晶体的化学式: 已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d亚层为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d亚层为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):