题目内容
13.下列事实中,不能用勒夏特列原理解释的是( )| A. | 冰镇的啤酒打开后泛起泡沫 | |
| B. | 由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| C. | 工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A、气体的溶解度随温度的升高而减小,随压强的增大而增大,由气体的溶解度随压强的增大而增大,因此常温时打开汽水瓶时,瓶内的压强减小,因此瓶内的二氧化碳会从瓶中溢出,可以用勒夏特列原理解释,故A不选;
B、由H2、I2(g)、HI气体组成的平衡,反应前后气体体积不变,减压后平衡不动,体积增大颜色变浅,不能用勒夏特列原理解释,故B选;
C、该反应是可逆反应,让K成蒸汽从反应混合物中分离出来,减小生成物的浓度能上平衡正向移动,能用勒夏特列原理解释,故C不选;
D、存在Cl2+H2O?HCl+HClO,生成的次氯酸见光分解,促进平衡正向进行,故氯水光照后颜色变浅,能用勒夏特利原理解释,故D不选;
故选B.
点评 本题考查了化学平衡移动原理的分析判断,影响因素的分析,平衡移动原理的理解是解题关键,题目难度中等.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
10.下列物质属于非电解质的是( )
| A. | NH4Cl | B. | Al | C. | AlCl3 | D. | NH3 |
8.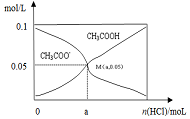 常温下向10mL 0.1mol•L-1CH3COONa溶液中,不断通入HCl后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液体积变化),下列说法不正确的是( )
常温下向10mL 0.1mol•L-1CH3COONa溶液中,不断通入HCl后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液体积变化),下列说法不正确的是( )
 常温下向10mL 0.1mol•L-1CH3COONa溶液中,不断通入HCl后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液体积变化),下列说法不正确的是( )
常温下向10mL 0.1mol•L-1CH3COONa溶液中,不断通入HCl后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液体积变化),下列说法不正确的是( )| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,c(H+)-c(OH-)=(100a-5.0×10-2) mol/L | |
| C. | 随着HCl的通入,$\frac{c(O{H}^{-})}{c(C{H}_{2}CO{O}^{-})}$值不断减小 | |
| D. | 当n(HCl)=1.0×10-3mol时,溶液中c(Na+)>c(Cl-)>c(CHCOO-)>c(H+)>c(OH-) |
18.对食物的酸、碱性判断正确的是( )
| A. | 西瓜是酸性食物 | B. | 猪肉、牛肉是碱性食物 | ||
| C. | 巧克力、奶油是酸性食物 | D. | 大米、面粉是碱性食物 |
5.下列关于物质的量的叙述中,正确的是( )
| A. | 1 mol任何物质中都含有6.02×1023个分子 | |
| B. | 0.012 kg 12C中含有约6.02×1023 NA个碳原子 | |
| C. | 1 mol水中含有1 mol氢分子和1 mol氧原子 | |
| D. | 1 mol Ne中约含有6.02×1024个电子 |
3.蒸干下列溶液能得到原溶液中溶质的是( )
| A. | AlCl3 | B. | Cu(NO3)2 | C. | FeSO4 | D. | Na2CO3 |