��Ŀ����
13��ij�о���ѧϰС�飬Ϊ��̽���������Ƶ�ǿ�����ԣ��������ͼ��ʵ��װ�ã�ʵ�鲽�輰�������£�
�ټ��װ�������Ժ�װ��ҩƷ������������
�ڻ���ͨ��һ������N2��װ��D���Ӻã�����ĩ��δ���뼯��ƿ�У�������Բ����ƿ�л����μ�Ũ���ᣬ��Ӧ���ң���������ɫ���壮
��һ��ʱ�������ĩ�����뼯��ƿ���ռ����壮װ��D���ռ�����ʹ�����ǵ�ľ����ȼ����ɫ���壮
�ܷ�Ӧ�����رշ�Һ©���Ļ�������ͨ��һ������N2����װ���������Ϊ��ɫ��

�ش��������⣺
��1��װ��B�е�ʪ��ĺ�ɫֽ����ɫ��֤��A�з�Ӧ��Cl2���ѧʽ�����ɣ���B�иķ�ʪ��ĵ���KI��ֽ����ƾ��ֽ������������֤���������ۣ��������ӷ���ʽ˵��ԭ��4H++4I-+O2�T2I2+2H2O��
��2��װ��C������������HCl������Cl2����ֹ��Ⱦ������ʹD�����ռ�����Ϊ������������
��3����ͬѧ��ΪO2��Na2O2�������е�HCl��ԭ���ã���ͬѧ��Ϊ�˽��۲���ȷ�������ܵ�����Ϊ��Na2O2����ԭʱ��Ԫ�صĻ��ϼ�Ӧ�ý��ͣ������ܵõ�O2����O2�п�����Na2O2�������е�H2O��Ӧ���ã�
��4��ʵ��֤����Na2O2������HCl�ܷ�Ӧ����ɲ���ƽ�û�ѧ����ʽ��Na2O2+HCl--Cl2+NaCl+Na2O2+4HCl�TCl2+2NaCl+2H2O
�÷�Ӧ���ܣ���ܡ����ܡ�������ʵ���ҿ�����ȡ������Cl2�������Ǣ�Na2O2�����ɵ�H2O��Ӧ��O2���ɣ����ɵ�Cl2�л�������HCl��H2O�Ȣ�ʵ����û�п�ֱ��ʹ�õĸ���HCl���壻���������巴Ӧ��������Ҫ����Ҫ�㣩
���� ��1��HClO��Ư���ԣ�������ˮ��Ӧ����HClO��O2��Cl2������ǿ�����ԣ����ܽ�����������ΪI2��I2��������Һ����ɫ��
��2��Cl2�ж�����ֱ���ſգ����O2�л���Cl2���ᵼ���ռ���O2��������
��3�����Na2O2����ԭ����OԪ��Ӧ�õõ��ӻ��ϼ۽��ͣ�Na2O2���ܺ�ˮ��Ӧ��������
��4��Na2O2+4HCl�TCl2+2NaCl+2H2O������ˮ��HCl��Na2O2��Ӧֻ�ܲ���������ʵ�����в��������ַ�����ȡ������ʵ�����еò�����ˮHCl�ҷ�Ӧ����������������Na2O2��Ӧ��������������������壬ʵ���Ҳ����ô˷��������Ʊ�������������
��� �⣺��1��ʪ��ĺ�ɫʯ����ֽ��ɫ��˵����HClO���ɣ�������ˮ��Ӧ����HClO������˵��װ��A����Cl2���ɣ���B�иķ�ʪ��ĵ���KI��ֽ�������Ӿ��л�ԭ�ԣ�O2��Cl2������ǿ�����ԣ����ܽ�����������ΪI2��I2��������Һ����ɫ�����������ӷ�Ӧ����ʽΪ4H++4I-+O2�T2I2+2H2O����4I-+O2+2H2O�T2I2+4OH-�������Բ��ܾݴ�֤���������ۣ��ʴ�Ϊ��Cl2��4H++4I-+O2�T2I2+2H2O��
��2��Cl2�ж�����ֱ���ſգ����O2�л���Cl2���ᵼ���ռ���O2����������������лӷ��ԣ��������ɵ������к���HCl��������HCl���ܺ�NaOH��Ӧ����ȥ����NaOH������������HCl������Cl2����ֹ��Ⱦ������ʹD�����ռ�����Ϊ�������������ʴ�Ϊ������HCl������Cl2����ֹ��Ⱦ������ʹD�����ռ�����Ϊ������������
��3�������Na2O2����ԭ����OԪ��Ӧ�õõ��ӻ��ϼ۽��ͣ������ǻ��ϼ����ߣ�Na2O2����ԭʱ��Ԫ�صĻ��ϼ�Ӧ�ý��ͣ������ܵõ�O2��ˮ�������Ʒ�ӦҲ����������O2�п�����Na2O2�������е�H2O��Ӧ���ɵģ��ʴ�Ϊ����Na2O2����ԭʱ��Ԫ�صĻ��ϼ�Ӧ�ý��ͣ������ܵõ�O2����O2�п�����Na2O2�������е�H2O��Ӧ���ã�
��4����Ӧ����ʽΪNa2O2+4HCl�TCl2+2NaCl+2H2O������ˮ��HCl��Na2O2��Ӧֻ�ܲ���������ʵ�����в��������ַ�����ȡ������ʵ�����еò�����ˮHCl�ҷ�Ӧ����������������Na2O2��Ӧ��������������������壬��ʵ���Ҳ����ô˷�Ӧ������ȡ������Cl2���ʴ�Ϊ��Na2O2+4HCl�TCl2+2NaCl+2H2O�����ܣ���Na2O2�����ɵ�H2O��Ӧ��O2���ɣ����ɵ�Cl2�л�������HCl��H2O�Ȣ�ʵ����û�п�ֱ��ʹ�õĸ���HCl���壻���������巴Ӧ������
���� ���⿼������ʵ��̽�������ؿ���ѧ�����ֲ����������������������ʵ�������ʵ����Ƶ����ݣ����ʡ��Ʊ�ʵ�鷽������Ǹ߿���Ƶ�㣬�ۺ��Խ�ǿ���漰֪ʶ��϶࣬��������Ԫ�ػ�����֪ʶ����Ŀ�Ѷ��еȣ�

 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д� ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�| A�� | ����ʧȥ�ĵ���������� | |
| B�� | L����ӱ�K����������� | |
| C�� | p�����������һ������s����������� | |
| D�� | ���������������˶��ĵ���������� |
��1��������Һ��������100mL1.5mol/L-1��Һ����ȡ20mL 36.5%������ϡ�͵�200mL������KOH��Һʱ��Ҫ�õIJ��������У��ձ�������������ͷ�ιܺ�100mL����ƿ��
��2���ζ������Է�̪��ָʾ�����жϵ���ζ��յ��ʵ����������Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ��
�ڲⶨ�Ľ�����±�
| �ⶨ���� | ��������/mL | KOH��Һ����� | |
| �ζ�ǰ�̶�/mL | �ζ���̶�/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
| A�� | �����ص�������Ӧ�������������ʴ������Ӧ���� | |
| B�� | ÿת��1mol���������ֵ�ز�������Ϊ0.5�ȵ� | |
| C�� | ��صĸ�����ӦΪ��CH4+10OH-�TCO32-+7H2O+8e- | |
| D�� | ������0.4molȼ��ʱ������еĸ������ӵ�Ũ�ȹ�ϵΪ��C��K+����C��HCO3-����C��CO32-����C��OH-����C��H+�� |
| A�� | 1.4g��ϩ���ϩ�Ļ�����庬��NA��̼ԭ�� | |
| B�� | ����ͭ��������ʧȥ2NA�����ӣ�����������64g | |
| C�� | ��1L 0.1mol/L��Na2CO3��Һ�У�����������С��0.1NA | |
| D�� | ��1L 2mol/L��FeCl3��Һ���뵽��ˮ�У�����ʹ֮��ȫ��Ӧ������������������������Ϊ2NA |
 15ml 0.1mol/L KOH��Һ�е���0.2mol/L��һԪ����HA������ҺpH�ͼ�������HA����Ĺ�ϵ������ͼ��ʾ���й�����Ũ�ȵĴ�С��ϵ��ȷ���ǣ�������
15ml 0.1mol/L KOH��Һ�е���0.2mol/L��һԪ����HA������ҺpH�ͼ�������HA����Ĺ�ϵ������ͼ��ʾ���й�����Ũ�ȵĴ�С��ϵ��ȷ���ǣ�������| A�� | ��A��B������һ�㣨������A��B���㣩��c��K+����c��A-����c��OH-����c��H+�� | |
| B�� | ��B�㣺c��A-��=c��K+����c��OH-��=c��H+������a=7.5 | |
| C�� | ��C�㣺c��A-����c��K+����c��OH-����c��H+�� | |
| D�� | ��D�㣺c��A -��+c��HA����2 c��K+�� |

 ��
��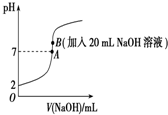 25���£���20mL 0.2mol•L-1��������еμ�0.2mol•L-1��NaOH��Һʱ����Һ��pH�仯��ͼ��ʾ����ش��������⣺
25���£���20mL 0.2mol•L-1��������еμ�0.2mol•L-1��NaOH��Һʱ����Һ��pH�仯��ͼ��ʾ����ش��������⣺
 ���÷�Ӧ������ȥ��Ӧ��
���÷�Ӧ������ȥ��Ӧ�� ��
�� ��
�� ��2��-CH3��
��2��-CH3�� �ı仯����
�ı仯���� ��
��