题目内容
从下列实验事实所得出的结论或给出的解释正确的是( )
| 实验事实 | 结论或解释 | |
| A. | 将40 g NaOH溶于1 L蒸馏水中. | 该 溶液中溶质的质量分数为3.84%,其物质的量浓度为1mol?L-1 |
| B. | 向盛有浓硝酸的试管中分别加入Al片和Cu片,前者没有明显现象,后者反应剧烈,产生大量红棕色气体. | 还原性Al<Cu |
| C. | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2,加热,没有红色沉淀生成. | 淀粉没有水解成葡萄糖 |
| D. | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.溶剂的体积不等于溶液的体积;
B.Al和浓硝酸发生钝化反应;
C.葡萄糖在碱性条件下与新制Cu(OH)2浊液反应;
D.向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,调节溶液的pH,促进Fe3+水解,也可以加入MgCO3、MgO等物质.
B.Al和浓硝酸发生钝化反应;
C.葡萄糖在碱性条件下与新制Cu(OH)2浊液反应;
D.向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,调节溶液的pH,促进Fe3+水解,也可以加入MgCO3、MgO等物质.
解答:
解:A.溶剂的体积不等于溶液的体积,溶液中溶质的质量分数为3.84%,但物质的量浓度不等于1mol/L,故A错误;
B.Al和浓硝酸发生钝化反应,但活泼性铝大于铜,可用稀硫酸证明,故B错误;
C.葡萄糖与新制Cu(OH)2浊液反应需在碱性条件下,应加入碱将水解后的淀粉溶液调节成碱性,才可以产生砖红色沉淀,故C错误;
D.向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤Fe3++3H2O?Fe(OH)3+3H+足量Mg(OH)2消耗H+促进Fe3+水解,使Fe3+完全水解成Fe(OH)3过滤除去,故D正确.
故选D.
B.Al和浓硝酸发生钝化反应,但活泼性铝大于铜,可用稀硫酸证明,故B错误;
C.葡萄糖与新制Cu(OH)2浊液反应需在碱性条件下,应加入碱将水解后的淀粉溶液调节成碱性,才可以产生砖红色沉淀,故C错误;
D.向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤Fe3++3H2O?Fe(OH)3+3H+足量Mg(OH)2消耗H+促进Fe3+水解,使Fe3+完全水解成Fe(OH)3过滤除去,故D正确.
故选D.
点评:本题属于常规实验与基本实验考查范畴,注意问题的性质,本题难度不大,注意基础知识的积累.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
把99.5mL 0.2mol/L NaOH溶液加到100.5mL 0.1mol/L H2SO4中,所得溶液的pH为( )
| A、1 | B、2.7 | C、3 | D、3.3 |
用NA表示阿伏加德罗常数.下列叙述正确的是( )
| A、25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA |
| B、标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
| C、在0℃、1.01KPa下,22.4L的NO气体与11.2L的O2混合,气体分子数为NA |
| D、在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA |
下列反应不属于加成反应的是( )
| A、CH2=CH2+H-OH→CH3-CH2-OH | ||
B、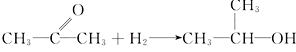 | ||
| C、CH3-CH=CH2+Br2→CH3CHBr→CH2Br | ||
D、N≡N+2H2
|
锂空气电池作为新一代大容量电池而备受瞩目,其工作原理如图所示.下列有关锂空气电池的说法不正确的是( )


| A、随着电极反应的不断进行,正极附近的电解液PH不断升高 |
| B、若把碱性电解液换成固体氧化物电解质,则正极会因为生成Li2O而引起碳孔堵塞,不利于正极空气的吸附 |
| C、放电时,当有22.4L O2(标准状况下)被还原时,溶液中有4mol Li+从左槽移动到右槽 |
| D、锂空气电池又称作“锂燃料电池”,其总反应方程为:4Li+O2═2Li2O |
下列离子方程式正确的是( )
| A、等体积、等物质的量浓度的NaHCO3溶液和Ca(OH)2溶液混合:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
| B、向漂白粉中通入少量的SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| C、过量的Fe与稀硝酸反应:3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O |
| D、过量的SO2通入到Ba(NO3)2溶液中:3SO2+2NO3-+3Ba2++2H2O═3BaSO4↓+2NO↑+4H+ |
