题目内容
N2(g)+3H2(g)
2NH3(g)△H<0.当反应达到平衡时,下列措施能提高N2转化率的是( )
①降温 ②恒压通入惰性气体 ③增加N2的浓度 ④加压.
| 催化剂 |
| 高温高压 |
①降温 ②恒压通入惰性气体 ③增加N2的浓度 ④加压.
| A、①④ | B、①② | C、②③ | D、③④ |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:N2(g)+3H2(g)
2NH3(g)△H<0,正反应是放热反应,是气体体积缩小的反应,结合外界条件对平衡的影响来综合分析.
| 催化剂 |
| 高温高压 |
解答:
解:①降温,平衡正向移动,氮气的转化率增大,故正确;
②恒压通入惰性气体,体积膨胀,相当于减小压强,平衡逆向移动,氮气的转化率降低,故错误;
③增加N2的浓度,平衡正向移动,氮气的转化率降低,故错误;
④加压,平衡正向移动,氮气的转化率增大,故正确;
故选A.
②恒压通入惰性气体,体积膨胀,相当于减小压强,平衡逆向移动,氮气的转化率降低,故错误;
③增加N2的浓度,平衡正向移动,氮气的转化率降低,故错误;
④加压,平衡正向移动,氮气的转化率增大,故正确;
故选A.
点评:本题考查外界条件对化学平衡的移动的影响,为高考常见题型,侧重于学生的分析能力的考查,注意把握相关知识的积累,难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
常温时,将pH=13的强碱溶液和pH=2的强酸溶液混合,所得溶液的pH=11,则强碱溶液和强酸溶液的体积之比为( )
| A、1:9 | B、9:1 |
| C、10:1 | D、1:10 |
常温时,下列溶液的pH或微粒的物质的量浓度关系不正确的是( )
| A、将0.2 mol?L-1的某一元酸HA溶液和0.1 mol?L-1 NaOH溶液等体积混合后,混合液pH大于7,则反应后的混合液:2c(OH一)+c(A-)═2c(H+)+c(HA) |
| B、某溶液中存在的离子有Cl-、OH-、NH4+、H+,则离子浓度不一定是c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、某物质的溶液中由水电离出的c(H+)=1×10-a mol?L-1,若a>7时,则该溶液的pH一定为14-a |
| D、pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)+c(HR一)=c(Na+) |
下列有关物质性质的应用不正确的是( )
| A、液氨汽化时要吸收大量的热,可用作制冷剂 |
| B、生石灰能与水反应,可用干燥氯气 |
| C、维生素C受热易被氧化,所以有些新鲜蔬菜生吃较好 |
| D、氮气的化学性质不活泼,可用作粮食和食品仓库的保护气 |
在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)?2C(g)+D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高.下列叙述正确的是( )
| 物 质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
| A、该反应是吸热反应 |
| B、该反应的平衡常数随温度的升高而增大 |
| C、压强升高时平衡常数也随之增大 |
| D、该反应的平衡常数随温度的升高而减小 |
下列变化必须加入氧化剂才能实现的是( )
| A、Cr2O72-→CrO42- |
| B、HNO3→NO2 |
| C、SiO2→Si |
| D、CH3CH2OH→CH3CHO |
下列说法中正确的是( )
| A、航天飞机上的隔热陶瓷瓦属于优质合金材料 |
| B、将少量CO2通入CaCl2溶液能生成白色沉淀 |
| C、蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性 |
| D、碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 |
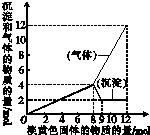 某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+,当加入一种淡黄色固体并加热溶液时,有刺激性气味气体放出和白色沉淀生成;加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系如图所示,问所加淡黄色固体是
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+,当加入一种淡黄色固体并加热溶液时,有刺激性气味气体放出和白色沉淀生成;加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系如图所示,问所加淡黄色固体是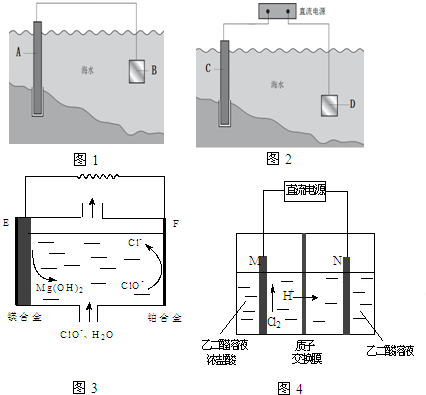 电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛.
电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛.