题目内容
常温时,将pH=13的强碱溶液和pH=2的强酸溶液混合,所得溶液的pH=11,则强碱溶液和强酸溶液的体积之比为( )
| A、1:9 | B、9:1 |
| C、10:1 | D、1:10 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:pH=13的强碱溶液中c(OH-)=0.1mol/L,pH=2的强酸溶液中c(H+)=0.01mol/L,混合液的pH=11,则混合溶液中c(OH-)=10-3mol/L=
,据此计算酸碱体积之比.
| c(OH-)V碱-c(H+)V酸 |
| V酸+V碱 |
解答:
解:pH=13的强碱溶液中c(OH-)=0.1mol/L,pH=2的强酸溶液中c(H+)=0.01mol/L,混合液的pH=11,则混合溶液中c(OH-)=10-3mol/L=
=
,解得:
=
,
故选A.
| c(OH-)V碱-c(H+)V酸 |
| V酸+V碱 |
| 0.1V碱-0.01V酸 |
| V酸+V碱 |
| V碱 |
| V酸 |
| 1 |
| 9 |
故选A.
点评:本题考查了pH的简单计算,根据混合溶液中氢氧根离子浓度计算公式进行计算即可,注意溶液酸碱性与溶液pH的关系,题目难度不大.试题侧重基础知识的考查.

练习册系列答案
相关题目
已知酸性: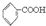 >H2CO3>
>H2CO3> >HCO3-将
>HCO3-将 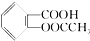 转变为
转变为 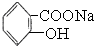 ,可行的方法是( )
,可行的方法是( )
 >H2CO3>
>H2CO3> >HCO3-将
>HCO3-将  转变为
转变为  ,可行的方法是( )
,可行的方法是( )| A、向该溶液中加入足量的稀硫酸,加热 |
| B、将该物质与稀硫酸共热后,再加入足量的NaOH溶液 |
| C、将该物质与足量的NaOH溶液共热,再通入足量CO2气体 |
| D、将该物质与稀硫酸共热后,再加入足量的NaHCO3溶液 |
在FeCl3溶液中,加入过量的铁粉,充分反应后,溶液中的金属离子是( )
| A、Fe2+ |
| B、Fe3+和Fe2+ |
| C、Fe3+ |
| D、Fe3+、Cl- |
下列说法不正确的是( )
| A、大量使用的不是纯金属而是它们的合金 |
| B、目前已制得的纯金属只有90多种,但制得的合金已达几千种 |
| C、钢是最纯的铁 |
| D、废弃铝质包装既浪费金属材料又造成环境污染 |
在下列物质的水溶液中分别加入澄清的石灰水后,原溶液中的阴离子和阳离子都减少的是( )
| A、FeCl2 |
| B、CuSO4 |
| C、Na2CO3 |
| D、Ba(NO3)2 |
 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图,下列说法正确的是( )| A、滴加过程中当溶液呈中性时,V(NaOH)≥20mL |
| B、当V(NaOH)=30mL时,则有:2c(Na+)=3c(A2-)+3c(HA-) |
| C、H 2A在水中的电离方程式是:H 2A→H++HA-; HA-?H++A2- |
| D、当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
N2(g)+3H2(g)
2NH3(g)△H<0.当反应达到平衡时,下列措施能提高N2转化率的是( )
①降温 ②恒压通入惰性气体 ③增加N2的浓度 ④加压.
| 催化剂 |
| 高温高压 |
①降温 ②恒压通入惰性气体 ③增加N2的浓度 ④加压.
| A、①④ | B、①② | C、②③ | D、③④ |
在下列反应中,水仅作还原剂的是( )
| A、Na2O+H2O=2NaOH | ||||
| B、2F2+2H2O=4HF+O2 | ||||
| C、C+H2O=CO+H2 | ||||
D、2H2O
|