题目内容
6.用NA表示阿伏伽德罗常数的值.下列判断正确的是( )| A. | 2gH2含有的氢原子数目为NA | |
| B. | 1L1mol•L-1KOH溶液中含有的钾离子数目为NA | |
| C. | 1molZn完全变为Zn2+失去的电子数目为NA | |
| D. | 常温常压下,22.4LO2含有的分子数目为NA |
分析 A.1个氢气分子含有2个氢原子;
B.依据n=CV 计算氢氧化钾的物质的量,氢氧化钾为强电解质完全电离,依次计算钾离子数目;
C.1个Zn变为Zn2+时失去2个电子;
D.常温常压下Vm≠22.4L/mol.
解答 解:A.1个氢气分子含有2个氢原子,2g H2的物质的量=$\frac{2g}{2g/mol}$=1mol,含氢原子个数为2NA,故A错误;
B.溶液中氢氧化钾的物质的量=1L×1mol•L-1 =1mol,氢氧化钾为强电解质完全电离,所以含钾离子的物质的量为1mol,个数为NA,故B正确;
C.1个Zn变为Zn2+时失去2个电子,1mol Zn变为Zn2+时失去的电子数目为2NA,故C错误;
D.常温常压下Vm≠22.4L/mol,22.4L O2的物质的量不是1mol,所以分子数不是NA,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意气体摩尔体积的使用条件.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
16.超音速飞机在平流层飞行时,尾气中的NO 会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO 和CO 转变成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO 和CO 浓度如下表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)写出该反应的平衡常数表达式K=$\frac{c({N}_{2})•c^2(C{O}_{2})}{c^2(NO)•c^2(CO)}$.
(2)前2s 内的平均反应速率v(CO2)=3.75×10-4mol/L•s.
(3)在上述条件下反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO 转化率的是CD.
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)在温度和体积保持不变的条件下,能够说明该反应达到平衡状态的标志是D.
A.反应混合物各组分物质的量浓度相等 B.NO、CO、CO2、N2分子数之比为2:2:2:1
C.混合气体的密度保持不变 D.单位时间内消耗1molNO 的同时,就有1molCO 生成.
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO 和CO 浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| -c(NO)/mol•L -1 | 1.00×10 -3 | 4.50×10-4 | 2.50×10 -4 | 1.50×10 -4 | 1.00×10 -4 | 1.00×10 -4 |
| -c(CO)/mol•L-1 | 3.60×10 -3 | 3.05×10 -3 | 2.85×10 -3 | 2.75×10 -3 | 2.70×10 -3 | 2.70×10-3 |
(1)写出该反应的平衡常数表达式K=$\frac{c({N}_{2})•c^2(C{O}_{2})}{c^2(NO)•c^2(CO)}$.
(2)前2s 内的平均反应速率v(CO2)=3.75×10-4mol/L•s.
(3)在上述条件下反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO 转化率的是CD.
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)在温度和体积保持不变的条件下,能够说明该反应达到平衡状态的标志是D.
A.反应混合物各组分物质的量浓度相等 B.NO、CO、CO2、N2分子数之比为2:2:2:1
C.混合气体的密度保持不变 D.单位时间内消耗1molNO 的同时,就有1molCO 生成.
17.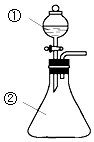 将①中液体逐滴滴入到②中(如图),实验结果与预测的现象一致的是( )
将①中液体逐滴滴入到②中(如图),实验结果与预测的现象一致的是( )
 将①中液体逐滴滴入到②中(如图),实验结果与预测的现象一致的是( )
将①中液体逐滴滴入到②中(如图),实验结果与预测的现象一致的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 氨水 | 氯化铝溶液 | 产生白色沉淀 |
| B | 浓硫酸 | 铜片 | 产生大量气体溶液变蓝 |
| C | 浓硝酸 | 用砂纸打磨过的铝条 | 产生大量红棕色气体 |
| D | 稀盐酸 | Na2CO3与NaOH的混合液 | 立即产生大量气体 |
| A. | A | B. | B | C. | C | D. | D |
14.在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8□反应中,正确的是( )
| A. | Cl2是还原产物 | |
| B. | □处对应的物质为H2O | |
| C. | 氧化剂与还原剂物质的量之比为1:8 | |
| D. | 若1mol KMnO4参加反应,转移的电子的物质的量是4mol |
11.下列有关说法正确的是( )
| A. | 顺-2-丁烯与反-2-丁烯与氢气加成的产物不相同 | |
| B. | 新戊烷的二氯代物有2种 | |
| C. | 分子式为C2H4和C4H8的物质一定互为同系物 | |
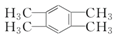
| D. | 键线式为  的有机物的分子式为C8H10 的有机物的分子式为C8H10 |