题目内容
18.把0.02mol/L CH3COOH溶液和0.01mol/LNaOH溶液等体积混合,溶液呈酸性,则混合溶液中微粒浓度关系不正确的是( )| A. | c(CH3COO-)>c (Na+) | B. | c(CH3COOH)+c(CH3COO-)=0.02mol/L | ||
| C. | c(CH3COOH)<c(CH3COO-) | D. | c(CH3COO-)+c(H+)=c (Na+)+c(OH-) |
分析 已知0.02mol•L-1CH3COOH溶液和0.01mol•L-1NaOH溶液以等体积混和后,得到的是同浓度的CH3COOH和CH3COONa溶液,溶液呈酸性说明醋酸电离大于醋酸根离子的水解程度,依据溶液中的离子关系分析判断;
A、依据溶液中电荷守恒分析判断;
B、根据溶液中阴阳离子电荷守恒
C、溶液呈酸性说明醋酸电离大于醋酸根离子的水解程度;
D、依据电荷守恒分析判断.
解答 解:A、0.02mol•L-1CH3COOH溶液和0.01mol•L-1NaOH溶液以等体积混和后,得到的是同浓度的CH3COOH和CH3COONa溶液,溶液中电荷守恒:c (Na+)+c (H+)=c (OH-)+c (CH3COO-),c (H+)>c (OH-),得到(CH3COO-)>c (Na+),故A正确;
B、依据溶液中物料守恒得到:c (CH3COOH)+c (CH3COO-)=0.01 mol•L-1,故B错误;
C、0.02mol•L-1CH3COOH溶液和0.01mol•L-1NaOH溶液以等体积混和后,得到的是同浓度的CH3COOH和CH3COONa溶液,溶液呈酸性说明醋酸电离大于醋酸根离子的水解程度,c (CH3COOH)<c (CH3COO-),故C正确;
D、依据溶液中电荷守恒得到:c (Na+)+c (H+)=c (OH-)+c (CH3COO-),故D错误;
故选BD.
点评 本题考查了溶液中离子浓度大小比较,溶液中电荷守恒,物料守恒的应用计算,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.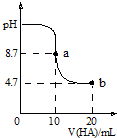 室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
 室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | pH=7时,c(Na+)=0.05 mol•L-1 | |
| C. | a、b两点溶液中水电离出c(H+)浓度的比值为104 | |
| D. | b点所示溶液中c(A-)<c(HA) |
9.聚合氯化铝(PAC)通式为[Al2(OH)nCl6-n]m,是无机高分子混凝剂,它是用软铝矿(主要成分Al2O3•H2O)为原料制备,制备的最后一步反应是将Al(OH)3凝胶与[Al(OH)2(H2O)4]Cl按照一定配比恰好完全反应制得PAC,则该反应中前者与后者的物质的量之比为( )
| A. | 1:1 | B. | $\frac{4-n}{6-n}$ | C. | $\frac{n-4}{6-n}$ | D. | $\frac{1}{m}$ |
13.有一种银锌电池,其电极分别为Ag2O和ZnO,电解质溶液为KOH,电极反应式分别为:
Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-,根据上述电极反应式,下列说法正确的是( )
Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-,根据上述电极反应式,下列说法正确的是( )
| A. | Zn是正极,Ag2O是负极 | |
| B. | 使用过程中,电子由Ag2O极经外路流向Zn极 | |
| C. | 使用过程中,电极负极区溶液的pH减小 | |
| D. | Zn电极发生氧化反应,Ag2O电极发生还原反应 |
10.下列说法错误的是( )
| A. | 金属的冶炼方法有4种,其中铝热反应属于热分解法 | |
| B. | 海带中碘元素的检验原理:2H++2I-+H2O2=I2+2H2O | |
| C. | 石油的分馏,裂化,裂解,催化重整中裂化是物理变化 | |
| D. | 铝热反应中铝做还原剂 |
7. 六种元素周期表中的位置如图,其中只有一种不是短周期元素,只有一种是金属元素,下列说法正确的是( )
六种元素周期表中的位置如图,其中只有一种不是短周期元素,只有一种是金属元素,下列说法正确的是( )
 六种元素周期表中的位置如图,其中只有一种不是短周期元素,只有一种是金属元素,下列说法正确的是( )
六种元素周期表中的位置如图,其中只有一种不是短周期元素,只有一种是金属元素,下列说法正确的是( )| A. | 简单离子半径大小:Q>Y>X | |
| B. | 最简单气态氢化物的沸点高低:Y>Z | |
| C. | Q的最高价氧化物可与X的氢化物直接反应 | |
| D. | X与Y既可存在于同一共价化合物中,也可存在于同一离子化合物中 |
12.下列说法正确的是( )
| A. | 原子最外层电子数为2的元素一定处于周期表ⅡA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5 | |
| C. | 氯化氢的沸点比氟化氢的沸点高 | |
| D. | 第三周元素的离子半径从左到右逐渐减小 |
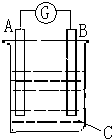 请根据图所示回答:甲装置是由铜、锌和稀硫酸组成的原电池,
请根据图所示回答:甲装置是由铜、锌和稀硫酸组成的原电池,