题目内容
6.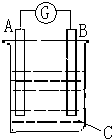 请根据图所示回答:甲装置是由铜、锌和稀硫酸组成的原电池,
请根据图所示回答:甲装置是由铜、锌和稀硫酸组成的原电池,(1)其中正极材料是铜,负极材料是锌.电解质溶液是稀硫酸;
(2)负极反应式为:Zn-2e-═Zn2+
(3)总的电极反应式表示为Zn+2H+=Zn2++H2↑.
分析 在用锌片、铜片和稀硫酸组成的原电池装置中,锌片的活泼性大于铜片的活泼性,所以锌片作负极,负极上锌失电子发生氧化反应,铜片作正极,正极上氢离子得电子发生还原反应,电子从负极沿导线流向正极,以此解答该题.
解答 解:(1)锌片的活泼性大于铜片的活泼性,所以锌片作负极,铜为正极,电解质为硫酸,故答案为:铜;锌;稀硫酸;
(2)该装置中,锌作负极,锌失电子发生氧化反应,电极反应式为:Zn-2e-═Zn2+,故答案为:Zn-2e-═Zn2+;
(3)总反应为Zn+2H+=Zn2++H2↑,故答案为:Zn+2H+=Zn2++H2↑.
点评 本题考查了原电池原理,为高频考点,难度不大,明确正负极的判断、电子的流向、电极反应式即可解答.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
16.有关过氧化钠和饱和氢氧化钠溶液反应的现象及所得溶液的判断不正确的是( )
| A. | 有气泡产生,该气体能使带火星的火柴梗复燃 | |
| B. | 反应后溶液中有晶体析出 | |
| C. | 反应前后溶液中钠离子的浓度不变 | |
| D. | 反应前后溶液中钠离子的质量不变 |
17.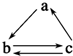 下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
 下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| 物质 选项 | a | b | c |
| A | Al | AlCl3 | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | H2SO4 | SO2 | SO3 |
| A. | A | B. | B | C. | C | D. | D |
1.在1L密闭容器内,一定条件下发生A+3B?2C反应,在10s内,反应物A的浓度由2mol降到1.2mol,则C的反应速率为( )
| A. | 1.6 mol/(L•s) | B. | 0.08 mol/(L•s) | C. | 0.16 mol/(L•s) | D. | 0.8 mol/(L•s) |
11.化学用语不正确的是( )
| A. | 醋酸的电离:CH3COOH?CH3COO-+H+ | |
| B. | 碳酸氢钠在水溶液中的电离:NaHCO3?Na++HCO3- | |
| C. | 氯化铵的水解:NH4++H2O?NH4OH+H+ | |
| D. | 碳酸钙的溶解平衡:CaCO3(s)?Ca2+(aq)+CO32-(aq) |
18.把0.02mol/L CH3COOH溶液和0.01mol/LNaOH溶液等体积混合,溶液呈酸性,则混合溶液中微粒浓度关系不正确的是( )
| A. | c(CH3COO-)>c (Na+) | B. | c(CH3COOH)+c(CH3COO-)=0.02mol/L | ||
| C. | c(CH3COOH)<c(CH3COO-) | D. | c(CH3COO-)+c(H+)=c (Na+)+c(OH-) |
16.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温下,2.24LCH4中含有0.4NA个共价键 | |
| B. | 100mL1mol•L-1NaAlO2溶液中含有0.1NA个AlO2- | |
| C. | 常温常压下,5.6gFe与足量稀硝酸反应,转移电子0.2NA个电子 | |
| D. | 标准状况下,1.12L1H2和0.2g2H2均含有0.1NA个质子 |