题目内容
3.利用锌锰干电池内的黑色固体水浸后的碳包滤渣(含MnO2、C、Hg2+等)制取MnSO4•H2O 的实验流程如图:
已知:25℃时,几种硫化物的溶度积常数如表:
| 物质 | FeS | MnS | HgS |
| 溶度积 | 5.0×l0-18 | 4.6×l0-14 | 2.2×l0-54 |
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀的pH | 3.7 | 9.7 | 9.8 |
(2)在加热条件下“浸取”,其原因是加快浸取时的反应速率;浸取时生成MnSO4和Fe2(SO4)3的化学方程式为9MnO2+2FeS+10H2SO4=9MnSO4+Fe2(SO4)3+10H2O.
(3)滤渣I的成分为MnO2、C和HgS(填化学式);若浸取反应在25℃时进行,FeS足量,则充分浸取后溶液中的$\frac{c(H{g}_{2}^{+})}{C(F{e}_{2}^{+})}$=4.4×10-37(填数值).
(4)“氧化”时的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;氧化时可用H2O2代替MnO2,H2O2的电子式为
 .
.(5)中和时,应该调节溶液pH的范围到3.7≤pH<8.3.
分析 将碳包滤渣(含MnO2、C、Hg2+等)溶于稀硫酸中,二氧化锰和汞离子溶于稀硫酸,C不溶于稀硫酸,向溶液中加入FeS,根据表中数据知,FeS转化为HgS沉淀,然后过滤,得到的滤渣1中含有C、HgS且还有未反应的FeS,二氧化锰和FeS发生氧化还原反应9MnO2+2FeS+20H+=9Mn2++2Fe3++2SO42-+10H2O,则得到的滤液中含有硫酸锰、硫酸铁,向滤液中加入二氧化锰,二氧化锰具有氧化性,酸性条件下能将Fe2+ 全部氧化为Fe3+,且不引入新杂质,然后向溶液中加入碳酸锰,调节溶液的pH值,将溶液中铁离子完全转化为氢氧化铁沉淀,而锰离子不反应,然后过滤得到的滤渣II为氢氧化铁,将滤液蒸发浓缩、冷却结晶得到MnSO4•H2O,据此分析解答.
解答 解:(1)蒸发实验操作时用到的硅酸盐材质的仪器有蒸发皿、玻璃棒、酒精灯;
故答案为:蒸发皿、玻璃棒、酒精灯;
(2)用酸浸取固体,加入硫化亚铁作还原剂,温度低,反应慢,故加热提高浸取的反应速率;浸取时反应生成MnSO4、Fe2(SO4)3,由此可判断出MnO2在酸性条件下氧化FeS,根据得失电子守恒配平反应,化学反应方程式为:9MnO2+2FeS+10H2SO4=9MnSO4+Fe2(SO4)3+10H2O;
故答案为:加快浸取时的反应速率;9MnO2+2FeS+10H2SO4=9MnSO4+Fe2(SO4)3+10H2O;
(3)得到的滤渣1中含有C、HgS且还有未反应的FeS,若浸取反应在25℃时进行,FeS足量,则充分浸取后溶液中的$\frac{c(H{g}^{2+})}{c(F{e}^{2+})}$=$\frac{Ksp(HgS)}{Ksp(FeS)}$=$\frac{2.2×1{0}^{-54}}{5.0×1{0}^{-18}}$=4.4×10-37;
故答案为:HgS;4.4×10-37;
(4)“氧化”过程,用MnO2将Fe2+ 全部氧化为Fe3+,发生的离子方程式为:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O,双氧水分子中H、O原子之间共用一对电子,且O、O原子之间共用一对电子,电子式 ;
;
故答案为:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O; ;
;
(5)将铁离子和锰离子分离,需要将铁离子转化为沉淀而锰离子不生成沉淀,根据表中生成沉淀所需pH值知,调节溶液的pH为3.7≤PH<8.3;
故答案为:3.7≤pH<8.3.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、溶度积的计算等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.

 出彩同步大试卷系列答案
出彩同步大试卷系列答案①酸 ②纯净物 ③氧化物 ④含氧酸 ⑤化合物⑥混合物 ⑦一元酸.
| A. | ①②③ | B. | ①②④⑤⑦ | C. | ③④⑥ | D. | ①③④⑤⑦ |
| A. | 4.4g由CO2和N2O组成的混合气体中的氧原子数为2.2NA | |
| B. | 12g由612C60和614C60组成的固体中的原子数为NA | |
| C. | 常温常压下,22.4LNH3中所含的共价键数为3NA | |
| D. | 1L1mol•L-1次氯酸溶液中的CIO-数为NA |
| 实验编号 | 起始浓度/mol•L-1 | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | X | 0.2 | 7 |
| A. | 实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+) | |
| B. | 实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=$\frac{{K}_{W}}{1×1{0}^{-5}}$mol•L-1 | |
| C. | 实验②反应后的溶液中:c(A-)+c(HA)>0.1mol•L-1 | |
| D. | 实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+) |
已知:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| S | 113 | 444 | 1.96 | 不溶于水 |
| S2Cl2 | -76 | 138 | 1.75 | 与水反应 |
| CS2 | -109 | 47 | 1.26 | 不溶于水 |
| CCl4 | -23 | 77 | 1.59 | 不溶于水 |
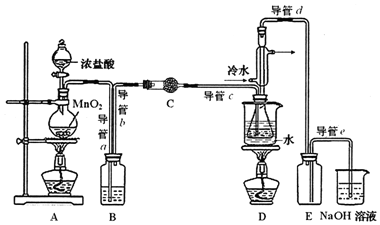
①通入C12 ②熄灭装置A中酒精灯 ③通入冷水④关闭冷水 ⑤加热装置D ⑥熄灭装置D中酒精灯
(2)为获得平缓稳定的Cl2气流,A装置的操作是控制分液漏斗下端的活塞,使浓盐酸匀速滴下.
(3)装置C中盛有的试剂是无水CaCl2(或P2O5);装置B中盛的试剂是饱和食盐水.
(4)装置D中冷凝管的作用是导气、冷凝回流;装置E的作用是防倒吸
(5)实验过程中,若缺少C装置,则产品浑浊不清并产生2种酸性气体,写出其反应的化学方程式2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑.
| A. | 0.1mol•L-1NaNO3与0.05mol•L-1Na2CO3溶液中的Na+离子数目 | |
| B. | 质量相等的石墨和C60中的碳原子数目 | |
| C. | 标准状况下等体积的SO2与SO3的分子数目 | |
| D. | pH都为3的稀盐酸与AlCl3溶液中,由水电离产生的H+离子数目 |