题目内容
10.在光照条件下,CH4与Cl2能发生取代反应:若将1 mol CH4与Cl2反应,待反应完成后测得四种有机取代物的物质的量之比为:n(CH3Cl):n(CH2Cl2):n(CHCl3):n(CCl4)=4:3:2:1,则消耗的Cl2为( )| A. | 1.0 mol | B. | 2.0 mol | C. | 3.0 mol | D. | 4.0 mol |
分析 根据碳原子守恒计算各氯代烃的物质的量,而甲烷与氯气发生取代反应得到氯代烃时,一半的氯原子得到氯代烃,一半氯原子生成HCl.
解答 解:得到n(CH3Cl):n(CH2Cl2):n(CHCl3):n(CCl4)=4:3:2:1,
根据碳原子守恒:4n(CCl4)+3n(CCl4)+2n(CCl4)+n(CCl4)=1mol,
则n(CCl4)=0.1mol
n(CH3Cl)=0.4mol
n(CH2Cl2)=0.3mol
n(CHCl3)=0.2mol
而甲烷与氯气发生取代反应得到氯代烃时,氯代烃与氯气的物质的量之比为1:1关系,
故需要氯气为:0.4mol×1+0.3mol×2+0.2mol×3+0.1mol×4=2mol,
故选:B.
点评 本题考查化学方程式计算、取代反应,关键是理解取代反应,注意取代反应的特点:逐步取代,多步同时发生.

练习册系列答案
相关题目
20.将0.8mol I2(g)和1.2mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)=2HI(g)并达到平衡.HI的体积分数随时间的变化如表格所示:
(1)在条件I到达平衡时,计算该反应的平衡常数K,要求列出计算过程.
(2)在条件I从开始反应到到达平衡时,H2的反应速率为0.12 mol/(L•min).
(3)为达到条件II的数据,对于反应体系可能改变的操作是降低温度.
(4)该反应的△H<0(填“>“,“<“或“=“)
(5)在条件I下达到平衡后,在7min时将容器体积压缩为原来的一半.请在图中画出c(HI)随时间变化的曲线.
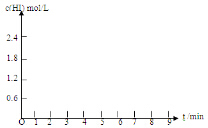
| HI体积分数 | 1min | 2min | 3min | 4min | 5min | 6min | 7min |
| 条件I | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
| 条件II | 20% | 33% | 43% | 52% | 57% | 65% | 65% |
(2)在条件I从开始反应到到达平衡时,H2的反应速率为0.12 mol/(L•min).
(3)为达到条件II的数据,对于反应体系可能改变的操作是降低温度.
(4)该反应的△H<0(填“>“,“<“或“=“)
(5)在条件I下达到平衡后,在7min时将容器体积压缩为原来的一半.请在图中画出c(HI)随时间变化的曲线.

1.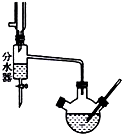 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表
请回答有关问题.
Ⅰ.乙酸正丁酯粗产品的制备在三孔圆底烧瓶中进行,并使用了分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管.实验需要的药品:浓硫酸、冰醋酸和正丁醇.
(1)写出生成乙酸正丁酯的方程式CH3CH2CH2CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2OOCCH3+H2O.
(2)正丁醇的核磁共振氢谱中峰面积之比是3:2:2:2:1.
(3)结合平衡移动原理进一步解释分水器的作用分离出生成的水,使得平衡向生成乙酸正丁酯的方向移动.
Ⅱ.乙酸正丁酯粗产品的精制
(1)将三颈圆底烧瓶中的液体转入分液漏斗中,并用饱和Na2CO3溶液洗涤有机层,用分液法可分离上述有机层和水层,分液完成后,取出有机层的操作是先放出下层的水层,再将有机层从上口倒入一个干燥的蒸馏烧瓶中.
(2)将酯层进行蒸馏.收集乙酸正丁酯产品.
Ⅲ.计算产率
如果实验中加入了18.5mL正丁醇、30mL冰醋酸和2mL浓硫酸,实验后制得的乙酸正丁酯的质量为0.11mol,则乙酸正丁酯的产率为55%.
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
Ⅰ.乙酸正丁酯粗产品的制备在三孔圆底烧瓶中进行,并使用了分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管.实验需要的药品:浓硫酸、冰醋酸和正丁醇.
(1)写出生成乙酸正丁酯的方程式CH3CH2CH2CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2OOCCH3+H2O.
(2)正丁醇的核磁共振氢谱中峰面积之比是3:2:2:2:1.
(3)结合平衡移动原理进一步解释分水器的作用分离出生成的水,使得平衡向生成乙酸正丁酯的方向移动.
Ⅱ.乙酸正丁酯粗产品的精制
(1)将三颈圆底烧瓶中的液体转入分液漏斗中,并用饱和Na2CO3溶液洗涤有机层,用分液法可分离上述有机层和水层,分液完成后,取出有机层的操作是先放出下层的水层,再将有机层从上口倒入一个干燥的蒸馏烧瓶中.
(2)将酯层进行蒸馏.收集乙酸正丁酯产品.
Ⅲ.计算产率
如果实验中加入了18.5mL正丁醇、30mL冰醋酸和2mL浓硫酸,实验后制得的乙酸正丁酯的质量为0.11mol,则乙酸正丁酯的产率为55%.
18.下列物质中不属于天然高分子化合物的是( )
| A. | 纤维素 | B. | 蛋白质 | C. | 油脂 | D. | 淀粉 |
5.我国正在推广使用乙醇汽油;所谓乙醇汽油就是在汽油中加入适量乙醇(一般为10:1)混合而成的一种燃料.下列有关的叙述错误的是( )
| A. | 由石油可以制得汽油 | |
| B. | 乙醇汽油是一种新型的化合物 | |
| C. | 汽车使用乙醇汽油可以减少有害气体的排放 | |
| D. | 由玉米、高梁发酵可以制得乙醇 |
15. 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成化学式为Z2T的离子化合物.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成化学式为Z2T的离子化合物.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成化学式为Z2T的离子化合物.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成化学式为Z2T的离子化合物.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 最高价氧化物对应的水化物的酸性:T<R | |
| C. | 气态氢化物的稳定性:Y>T | |
| D. | 由X、Y、Z、T四种元素组成的化合物水溶液一定呈中性 |
2.物质在下列应用中,利用了其还原性的是( )
| A. | 纯碱去油污 | B. | 铝冶炼金属 | C. | 硝酸制炸药 | D. | 漂粉精漂白织物 |
20.不能用焰色反应鉴别的下列各组物质的是( )
| A. | NaCl和Na2CO3 | B. | Na2CO3和BaCO3 | C. | CuCl2和CaCl2 | D. | Na2O2和K2O2 |