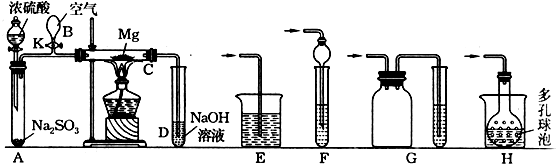
题目内容
4.设NA为阿伏加德罗常数值.下列有关叙述正确的是( )| A. | 1 molN2与3 mol H2反应生成的NH3分子数为2NA | |
| B. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| C. | 常温下,4 g CH4含有2 NA个C-H共价键 | |
| D. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
分析 A、合成氨的反应为可逆反应;
B、铁和过量的硝酸反应后变为+3价;
C、求出甲烷的物质的量,然后根据1mol甲烷中含4molC-H键来分析;
D、NO2和CO2中均含2个氧原子.
解答 解:A、合成氨的反应为可逆反应,故反应不能进行彻底,故生成的氨气分子数小于2NA个,故A错误;
B、铁和过量的硝酸反应后变为+3价,故1mol铁反应后失去3NA个电子,故B错误;
C、4g甲烷的物质的量为n=$\frac{4g}{16g/mol}$=0.25mol,而1mol甲烷中含4molC-H键,故0.25mol甲烷中含NA条C-H键,故C错误;
D、NO2和CO2中均含2个氧原子,故NA个NO2和CO2分子中含有2NA个氧原子,与两者的比例无关,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 所有糖类都能发生水解反应 | B. | 所有糖类物质都有甜味 | ||
| C. | 油与脂肪属于甘油酯 | D. | 葡萄糖与麦芽糖互为同分异构体 |
15.如图是铝热反应的实验装置,有关该反应的下列说法中不正确的是( )
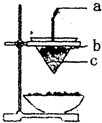
①a为铝条②b为氧化铁与铝粉的混合物
③2mol氧化剂参与反应则电子转移6NA个④还原剂与氧化产物的物质的量之比为1:2.

①a为铝条②b为氧化铁与铝粉的混合物
③2mol氧化剂参与反应则电子转移6NA个④还原剂与氧化产物的物质的量之比为1:2.
| A. | ①②④ | B. | ①②③ | C. | ②③ | D. | 全部 |
19.工业上冶炼金属一般用热分解法、热还原法和电解法.采用的不同的冶炼方法.你认为选择的原则主要是依据( )
| A. | 金属熔点的高低 | B. | 金属阳离子得电子的能力 | ||
| C. | 金属在自然界的存在形式 | D. | 金属元素在地壳中的含量 |
16.电离平衡常数是衡量弱电解质电离程度的量.已知如表数据(25℃):
(1)25℃时,等浓度的三种溶液(A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液)的pH由大到小的顺序为b>a>c.(填写序号)
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+CO2+H2O=NaHCO3+HCN.
(3)现有浓度为0.02mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是B、D.
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(H+)+c(HCN)=c(OH-)
D.c(HCN)+c(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);电荷守恒表达式c(OH-)+c(HC2O4-)+2c (C2O42-)=c(H+)+c(Na+).
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO4-+H+→CO2+Mn2++H2O,反应中每生成标况下4.48LCO2气体,转移的电子的物质的量为0.2mol.
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+CO2+H2O=NaHCO3+HCN.
(3)现有浓度为0.02mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是B、D.
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(H+)+c(HCN)=c(OH-)
D.c(HCN)+c(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);电荷守恒表达式c(OH-)+c(HC2O4-)+2c (C2O42-)=c(H+)+c(Na+).
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO4-+H+→CO2+Mn2++H2O,反应中每生成标况下4.48LCO2气体,转移的电子的物质的量为0.2mol.
13.制造保险丝时,在铅中加入锑和少量其他金属的最主要原因是( )
| A. | 升高熔点 | B. | 降低熔点 | C. | 减小硬度 | D. | 增强抗腐蚀能力 |
14.丙烯酸的结构简式为CH2═CHCOOH,下列关于丙烯酸的说法错误的是( )
| A. | 丙烯酸所有原子可能共平面 | |
| B. | 丙烯酸可以发生取代反应 | |
| C. | 丙烯酸可以使酸性高锰酸钾溶液褪色 | |
| D. | 丙烯酸与HBr发生加成反应只能得到唯一产物 |
 )是显影技术中的中间体.回答下列问题:
)是显影技术中的中间体.回答下列问题: .
.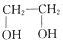 )可合成环酯,该反应的化学方程式为
)可合成环酯,该反应的化学方程式为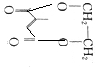 .
.