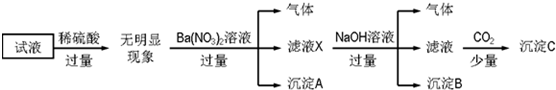
题目内容
9.实验装置如图所示.先关闭K,使A中的反应进行,加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质.实验完成后,将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成.请回答下列有关问题: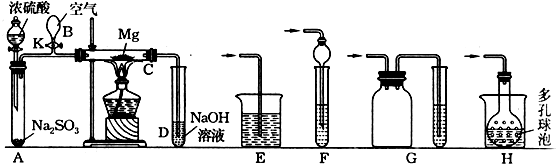
(1)C中全部产物有MgO、MgS、S.
(2)本实验先使A中反应进行,再加热C装置,其目的是排净空气(防止Mg和氧气、氮气反应).
(3)停止实验时,先打开K,再停止滴加浓硫酸,熄灭酒精灯,橡胶气胆B在实验中的作用是防止C降温时因C中气体压强减小而引起D中溶液的倒吸.
(4)若无装置B、K,使用普通导管,本实验的尾气吸收装置可以选用上图中装置F、G、H(填写序号,多选扣分).
(5)C中的Mg应放在不锈钢垫片上而不能直接接触管壁的原因是防止Mg和玻璃中的SiO2反应.
分析 浓硫酸和亚硫酸钠反应生成二氧化硫气体,Mg与SO2在加热的条件下能够发生化学反应生成淡黄色固体S,臭鸡蛋气味的气体为硫化氢,因此二氧化硫与Mg反应产物为MgS、S.根据元素守恒可知,另外一种产物为氧化镁,打开K,将空气充入反应反应体系,可平衡容器内外压强,防止倒吸,
(1)浓硫酸和亚硫酸钠反应生成二氧化硫气体,二氧化硫与Mg反应,生成淡黄色固体S,臭鸡蛋气味的气体为硫化氢,因此二氧化硫与Mg反应产物为MgS;
(2)A中反应生成气体吧装置中空气赶出,避免镁和空气成分发生反应;
(3)橡胶气胆B在实验中的作用是平衡压强防止倒吸;
(4)尾气成分为二氧化硫气体,吸收尾气需要防止倒吸;
(5)镁接触玻璃和玻璃中二氧化硅反应.
解答 解:(1)浓硫酸和亚硫酸钠反应生成二氧化硫气体,二氧化硫与Mg反应,生成淡黄色固体S,臭鸡蛋气味的气体为硫化氢,因此二氧化硫与Mg反应产物为MgS.根据元素守恒可知,另外一种产物为氧化镁,
故答案为:MgO;MgS; S.
(2)A中反应生成气体吧装置中空气赶出,避免镁和空气成分发生反应,本实验先使A中反应进行,再加热C装置,其目的是排净空气(防止Mg和氧气、氮气反应),
故答案为:排净空气(防止Mg和氧气、氮气反应);
(3)停止实验后,温度降低导致体系内部压强减小,容易发生倒吸,打开K,将空气充入反应反应体系,可平衡容器内外压强,防止倒吸,
故答案为:防止C降温时因C中气体压强减小而引起D中溶液的倒吸;
(4)尾气成分为二氧化硫气体,若无装置B、K,使用普通导管,吸收尾气需要防止倒吸,装置图中E不能防止倒吸,FGH都可以防止倒吸,
故答案为:F、G、H;
(5)金属镁是活泼金属,接触玻璃会和玻璃中二氧化硅反应,C中的Mg应放在不锈钢垫片上而不能直接接触管壁的原因是:防止Mg和玻璃中的SiO2反应,故答案为:防止Mg和玻璃中的SiO2反应.
点评 本题考查了物质实验室制备原理和装置选择,实验步骤的设计分析判断,物质性质的应用是解题关键,题目难度中等.

| A. | 通CO的一极是电池的负极 | |
| B. | 负极发生的电极反应是:O2+2CO2+4e-═2CO32- | |
| C. | 正极发生的电极反应是:CO+CO32--2e-═2CO2 | |
| D. | 正极发生还原反应 |
| A. | 1 molN2与3 mol H2反应生成的NH3分子数为2NA | |
| B. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| C. | 常温下,4 g CH4含有2 NA个C-H共价键 | |
| D. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
 研究小组用如图装置制取Cl2,证明产生的气体中含有HCl.
研究小组用如图装置制取Cl2,证明产生的气体中含有HCl.(1)仪器A的名称为圆底烧瓶;A中反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+2H2O+Mn2+;
(2)甲同学将A中产生的气体通入如表溶液:
| 实验序号 | 试剂 | 现象 |
| a | 紫色石蕊溶液 | 先变红后褪色 |
| b | AgNO3溶液 | 出现白色沉淀 |
②不能证明产生的气体中含有HCl的实验是ab(填字母序号);
(3)已知将HCl气体通入饱和食盐水中有白色固体析出.乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因Cl2+H2O?HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,也能析出晶体;
(4)已知:2S2O32-+I2═S4O62-+2I-.丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl.
I.测定X中溶解的Cl2.取25.00mL溶液X,加入过量KI溶液,然后用0.04mol•L-1 Na2S2O3溶液滴定生成
的I2,达滴定终点时消耗Na2S2O3溶液V mL.
Ⅱ.测定X中Cl元素总量.另取25.00mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10mol•L-1 AgNO3溶液滴定所得溶液中的Cl-.
①X中的HClO不会影响I的测定结果,原因是生成1mol HClO需消耗1mol Cl2,HClO也有氧化性,1mol HClO和1mol Cl2均能将2mol KI氧化成I2;
②由I、Ⅱ中实验数据可证明A中产生的气体中含有HCl,则Ⅱ中消耗0.10mol•L-1 AgNO3溶液的体积应大于0.4VmL(用含V的代数式表示).
 研究表明,在CuZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
研究表明,在CuZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1 平衡常数K1 反应Ⅰ
CO2(g)+H2(g)?CO(g)+H2O(g)△H2=+41.2kJ•mol-8平衡常数K2 反应Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如表实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
(1)合成的甲醇可用于燃料电池的燃料,若电解质为稀烧碱溶液时甲醇燃料电池的正极反应式为O2+4e-+2H2O=4OH-;研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在阴极,该电极反应式是CO2+6e-+6H+=CH3OH+H2O.
(2)从表中实验数据可以分析出,提高CO2转化成CH3OH的选择性的方法有使用Cat2催化剂(或理想催化剂);温度为543K(或降低温度).
(3)反应CO(g)+2H2(g)?CH3OH(g)的平衡常数K3=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示).
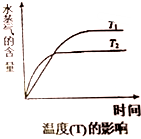
(4)在恒压密闭容器中,由CO2和H2进行反应I合成甲醇,在其它条件不变的情况下,探究温度对化学平衡的影响,实验结果如图.
①△H1<0(填“>”、“<”或“=”)
②有利于提高CO2平衡转化率的措施有A(填标号).
A.降低反应温度
B.投料比不变,增加反应物的浓度
C.增大CO2和H2的初始投料比
D.混合气体中掺入一定量惰性气体(不参与反应)
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为P0,仅进行反应I.
①充分反应达到平衡后,若CO2转化率为a,则容器的压强与起始压强之比为$\frac{2-a}{2}$(用a表示).
②若经过3h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为0.5mol•L-1•h-1(保留三位有效数字);该温度下反应的化学平衡常数K为0.148(L•mol-1)2(保留三位有效数字);平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数.写出上述反应压力平衡常数KP为$\frac{64}{27{P}_{0}^{2}}$(用P0表示,并化简).