题目内容
下列物质中,含有极性键的离子化合物是( )
| A、KCl |
| B、H2O2 |
| C、Na2O2 |
| D、NaOH |
考点:离子化合物的结构特征与性质,极性键和非极性键
专题:化学键与晶体结构
分析:一般来说,活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性共价键,同种非金属元素之间易形成非极性共价键,含有离子键的化合物是离子键化合物,如部分碱、大多数盐及金属氧化物,离子化合物中可能含有共价键.
解答:
解:A.KCl中钾离子和氯离子之间只存在离子键,为离子化合物,故A错误;
B.双氧水分子中H原子和O原子之间存在极性键、O原子和O原子之间存在非极性键,为共价化合物,故B错误;
C.过氧化钠中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在非极性键,为含有非极性键的离子化合物,故C错误;
D.NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性键,为含有极性键的离子化合物,故D正确;
故选D.
B.双氧水分子中H原子和O原子之间存在极性键、O原子和O原子之间存在非极性键,为共价化合物,故B错误;
C.过氧化钠中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在非极性键,为含有非极性键的离子化合物,故C错误;
D.NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性键,为含有极性键的离子化合物,故D正确;
故选D.
点评:本题考查了化学键的判断、化合物类型的判断,根据微粒间存在的作用力确定化学键,根据物质的构成微粒确定化合物类型,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
将a g Fe、Mg合金溶解在一定量的稀硝酸中,当合金完全溶解后,收集到标准状况下的NO气体b L(设HNO3的还原产物只有NO),再向反应后的溶液中加入足量NaOH溶液,得到沉淀物.若用守恒法求沉淀的质量,用到的守恒关系依次是( )
| A、质量守恒、电子守恒、电荷守恒 |
| B、电子守恒、质量守恒、电荷守恒 |
| C、电子守恒、电荷守恒、质量守恒 |
| D、电荷守恒、质量守恒、电子守恒 |
化学与社会生活密切相关,下列说法正确的是( )
| A、PM2.5是指空气中直径≤2.5μm的颗粒物,直径为2.5μm的颗粒物分散在空气中形成胶体(1μm=10-6m) |
| B、甲壳素、棉花、铜氨纤维、涤纶、光导纤维都是有机高分子材料 |
| C、有一种新发现的固态碳,称为“纳米泡沫”,外形似海绵,密度小,有磁性,这种碳与金刚石的关系是同素异形体 |
| D、亚硝酸钠是有毒物质,不能添加到食物中 |
下列说法正确的是( )
| A、农业废弃物、城市与工业有机废弃物及动物粪便中都蕴藏着丰富的生物质能 |
| B、羊毛、过氧化氢酶、牛胰岛素、血红蛋白、人造奶油充分水解均可得到氨基酸 |
| C、石墨烯是一种从石墨材料中用“撕裂”方法剥离出的单层碳原子面材料,用这种方法从C60、金刚石等中获得“只有一层碳原子厚的碳薄片”也必将成为研究方向 |
| D、多植树造林,使用“乙醇汽油”,改燃煤为燃气,外出时使用PM2.5口罩等都是治理“雾霾”等灾害性天气的有效措施 |
某短周期元素最高正价与最低负价的绝对值之差为6,该元素的离子与跟其核外电子排布相同的离子形成的化合物是( )
| A、MgS |
| B、NaF |
| C、KCl |
| D、Na2O |
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、32g O2气体含有的氧原子数为NA |
| B、2L 0.3mol/L Na2SO4溶液中含有Na+为0.6NA |
| C、27g铝完全反应后失去的电子数为3NA |
| D、11.2L氮气所含的分子数为0.5NA |
下列说法正确的是( )
A、1mol阿司匹林( )与足量的NaOH溶液反应,消耗NaOH最大的物质的量为2mol )与足量的NaOH溶液反应,消耗NaOH最大的物质的量为2mol |
| B、汽油、柴油等矿物油与植物油主要成分都是烃,均可以萃取溴水中的溴 |
| C、丙氨酸和苯丙氨酸脱水,最多可生成4种二肽 |
D、按系统命名法,化合物 的名称为2甲基5异丙基庚烷 的名称为2甲基5异丙基庚烷 |
 环六次甲基四胺是一种重要的化工原料,其结构式如图所示.下列关于环六次甲基四胺分子结构的叙述中正确的是( )
环六次甲基四胺是一种重要的化工原料,其结构式如图所示.下列关于环六次甲基四胺分子结构的叙述中正确的是( )| A、分子中所有的N,C原子共面 |
| B、结构式中打*的N原子处于分子的中心 |
| C、分子中含有3个相同的C,N交替排列的六元环 |
| D、连接分子中的4个N原子可构成一个正四面体 |
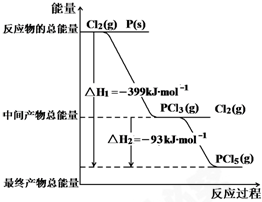 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示( 图中的△H表示生成1mol产物的数据).根据图示,回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示( 图中的△H表示生成1mol产物的数据).根据图示,回答下列问题: