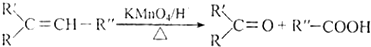题目内容
某短周期元素最高正价与最低负价的绝对值之差为6,该元素的离子与跟其核外电子排布相同的离子形成的化合物是( )
| A、MgS |
| B、NaF |
| C、KCl |
| D、Na2O |
考点:原子结构与元素的性质
专题:原子组成与结构专题
分析:某短周期元素最高正价与最低负价的绝对值之差为6,其最高正价和最低负价的绝对值之和为8,则该元素的最高正价是7、最低负价是-1,则该元素为第VIIA族元素,据此分析解答.
解答:
解:某短周期元素最高正价与最低负价的绝对值之差为6,其最高正价和最低负价的绝对值之和为8,则该元素的最高正价是7、最低负价是-1,则该元素为第VIIA族元素,F元素没有正化合价,所以排除F元素,与该元素的离子具有相同电子层结构的阳离子位于其下一周期第IA族或第IIA族,
A.S元素位于第VIA族,不符合题意,故A错误;
B.F元素位于第VIIA族,但F元素没有正化合价,故B错误;
C.Cl元素位于第VIIA族,K+和Cl-电子层结构相同,符合条件,故C正确;
D.O元素位于第VIA族,不符合题意,故D错误;
故选C.
A.S元素位于第VIA族,不符合题意,故A错误;
B.F元素位于第VIIA族,但F元素没有正化合价,故B错误;
C.Cl元素位于第VIIA族,K+和Cl-电子层结构相同,符合条件,故C正确;
D.O元素位于第VIA族,不符合题意,故D错误;
故选C.
点评:本题考查了原子结构和元素性质,明确元素周期表结构及原子结构是解本题关键,再结合元素性质分析解答,题目难度不大.

练习册系列答案
相关题目
下列分离或提纯方法正确的是( )
| A、采用结晶的方法除去氯化钠溶液中的泥沙 |
| B、用酒精萃取溴水中的溴单质 |
| C、用蒸馏的方法分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃) |
| D、用过滤的方法从含有少量氯化钠溶液的硝酸钾溶液中提取硝酸钾 |
下列说法正确的是( )
| A、按系统命名法,有机物(CH3)2CHCH(CH2CH3)(CH2CH2CH3)的命名为:2-甲基-3-丙基戊烷 |
B、已知C-C键可以绕键轴自由旋转,结构简式为 ,分子中至少有7个碳原子处于同一直线上 ,分子中至少有7个碳原子处于同一直线上 |
C、 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O5Na4 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O5Na4 |
D、肌醇  与葡萄糖 与葡萄糖 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 |
下列物质中,含有极性键的离子化合物是( )
| A、KCl |
| B、H2O2 |
| C、Na2O2 |
| D、NaOH |
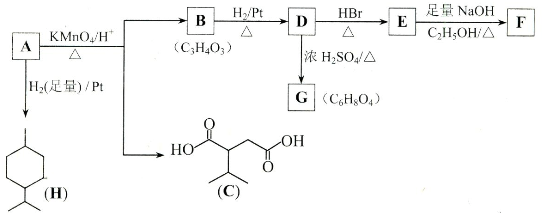
食品抗氧化剂是能阻止或延缓食品氧化变质、提高食品稳定性和延长贮存期的食品添加剂.BHT是一种常用的食品抗氧化剂,合成方法有如下两种:
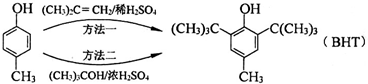
下列说法不正确的是( )

下列说法不正确的是( )
A、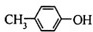 与BHT为同系物 与BHT为同系物 |
B、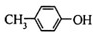 能发生氧化反应 能发生氧化反应 |
| C、BHT不能与NaHCO3溶液反应生成CO2 |
| D、两种方法的反应类型都是加成反应 |
短周期中的A、B、C、D、E五种元素,原子序数依次增大.A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等.则下列说法正确的是( )
| A、B与A只能组成BA3化合物 |
| B、C、D、E形成的化合物水溶液可能显碱性 |
| C、A、B、C形成的化合物一定不能发生水解反应 |
| D、E的氧化物对应的水化物只具有氧化性 |
下列有关有机物的说法中正确的是( )
| A、所有的有机物都很容易燃烧 |
| B、乙烷不能使高锰酸钾溶液褪色 |
| C、符合同一通式的有机物一定互为同系物 |
| D、易溶于汽油、酒精、苯等有机溶剂中的物质一定是有机物 |
丙烯醇在一定条件下可转化为丙烯醛:CH2=CHCH2OH
CH2=CHCHO.下列有关说法错误的是( )
| 新制MnO2 |
| 25℃ |
| A、丙烯醇与丙醛(CH3CH2CHO)互为同分异构体 |
| B、丙烯醇含有两种官能团 |
| C、可用新制Cu(OH)2鉴别丙烯醛和丙烯醇 |
| D、此转化过程中丙烯醇被还原 |