题目内容
10. A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.
A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.根据以上信息,回答下列问题.
(1)①A和D的氢化物中,沸点较高的是HF(填化学式),原因是HF分子之间存在氢键;
②A、B、D的电负性由大到小的顺序是F>Cl>Na(填元素符号);
③A、B、C的简单离子中,半径最大的是F-(填离子符号);
④C和D形成的化合物属于分子晶体;
⑤D元素的所有含氧酸中,酸性最强的是高氯酸(填名称),氧化性最强的是H-O-Cl(填结构式).
(2)写出B、C的最高价氧化物的水化物相互反应的离子方程式:OH-+Al(OH)3═AlO2-+2H2O.
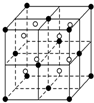
(3)A和E可组成离子化合物,其晶胞结构如图所示:
①阳离子(用“●”表示)位于大立方体的顶点或面心;阴离子(用“○”表示)均位于小立方体(1/8晶胞)的中心.该化合物的化学式是CaF2,与一个“●”距离最近的“●”有12个;
②G元素的原子序数为A和E的原子序数之和,请写出G的核外电子排布式:[Ar]3d104s1;
③已知晶胞的边长为a cm,A和E组成的离子化合物的密度为 ρ g/cm3,求NA的表达式.
分析 A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,A、D原子中某p能级均排有5个电子,外围电子排布为ns2np5,可推知A为F元素、D为Cl元素,B、C、D同周期,处于第三周期,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水,应是氢氧化铝、强碱、强酸反应,可推知B为Na、C为Al;E和其他元素既不在同周期也不在同主族,只能处于第四周期ⅡA族,则E为Ca.
(1)①HF分子之间存在氢键,其沸点高于HCl的;
②同主族自上而下电负性减小,非金属性越强电负性越大;
③离子电子层结构相同,核电荷数越大离子半径越小,离子电子层越多离子半径越多;
④C和D形成的化合物为AlCl3,属于分子晶体;
⑤Cl元素的所有含氧酸中,氯元素化合价越高,酸性越强,化合价越低,氧化性越强;
(2)B、C的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水;
(3)①利用均摊法计算钙离子、氟离子数目,确定化学式;
以顶点“●”研究,与之距离最近的“●”位于面心上,每个顶点为8个晶胞共用,每个面心为2个晶胞共用;
②G元素的原子序数为A和E的原子序数之和,则G原子核外电子数为9+20=29,根据能量最低原理书写原子核外电子排布式;
③结合晶胞含有原子数目,用阿伏伽德罗常数表示出晶胞质量,再根据m=ρV计算.
解答 解:A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,A、D原子中某p能级均排有5个电子,外围电子排布为ns2np5,可推知A为F元素、D为Cl元素,B、C、D同周期,处于第三周期,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水,应是氢氧化铝、强碱、强酸反应,可推知B为Na、C为Al;E和其他元素既不在同周期也不在同主族,只能处于第四周期ⅡA族,则E为Ca.
(1)①HF分子之间存在氢键,其沸点高于HCl的,故答案为:HF;HF分子之间存在氢键;
②同主族自上而下电负性减小,非金属性越强电负性越大,故电负性F>Cl>Na,故答案为:F>Cl>Na;
③F-、Na+、Al3+离子电子层结构相同,核电荷数越大离子半径越小,故离子半径F->Na+>Al3+,故答案为:F-;
④C和D形成的化合物为AlCl3,属于分子晶体,故答案为:分子;
⑤Cl元素的所有含氧酸中,氯元素化合价越高,酸性越强,化合价越低,氧化性越强,故酸性最强的是高氯酸,氧化性最强的是次氯酸,结构简式为H-O-Cl,
故答案为:高氯酸;H-O-Cl;
(2)B、C的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应离子方程式为:OH-+Al(OH)3═AlO2-+2H2O,
故答案为:OH-+Al(OH)3═AlO2-+2H2O;
(3)①该晶胞中阴离子(F-)数目为8、阳离子(Ca2+)数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,该化合物的化学式是 CaF2,
以顶点“●”研究,与之距离最近的“●”位于面心上,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,故与一个“●”距离最近的“●”有$\frac{3×8}{2}$=12个,
故答案为:CaF2;12;
②G元素的原子序数为A和E的原子序数之和,则G原子核外电子数为9+20=29,原子核外电子排布式为:[Ar]3d104s1,
故答案为:[Ar]3d104s1;
③晶胞的质量=4×$\frac{(40+19×2)g/mol}{{N}_{A}}$,晶胞的边长为a cm,密度为 ρ g/cm3,则4×$\frac{(40+19×2)g/mol}{{N}_{A}}$=(a cm)3×ρ g/cm3,则NA=$\frac{312}{ρ{a}^{3}}$mol-1,
故答案为:$\frac{312}{ρ{a}^{3}}$mol-1.
点评 本题是对物质结构的考查,涉及分子结构与性质、元素周期律、晶胞结构与计算等,理解掌握均摊法进行晶胞的有关计算.

 阅读快车系列答案
阅读快车系列答案| A. | NaHSO4溶液与Ba(OH)2溶液混合 | B. | NH4Cl溶液与Ca(OH)2溶液混合 | ||
| C. | HNO3溶液与KOH溶液混合 | D. | Na2HPO4溶液与NaOH溶液混合 |
| A. | C57H104O6 | B. | C57H108O6 | C. | C57H106O6 | D. | C57H102O6 |
| A. | 雾霾的形成与化石燃料的燃烧有关 | |
| B. | 海南不存在雾霾天气,无需防治PM2.5的污染 | |
| C. | 在雾霾天气中行车,打开车灯可观察到丁达尔效应 | |
| D. | 调整工业能源结构,推广清洁能源的使用,能有效地减少PM2.5的污染 |
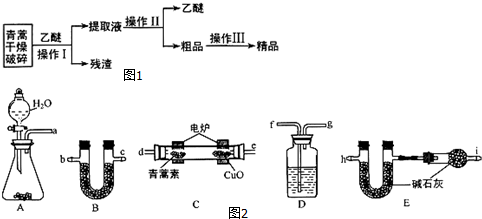
请回答下列问题:
(1)对青蒿进行破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率.
(2)操作Ⅰ用到的玻璃仪器是漏斗、玻璃棒、烧杯,操作Ⅱ的名称是蒸馏.
(3)用如图2的实验装置测定青蒿素的化学式,将28.2g青蒿素放在燃烧管C中充分燃烧:
①仪器各接口的连接顺序从左到右依次为afgdebchi(每个装置限用一次).
②装置C中CuO的作用是使青蒿素充分氧化生成CO2和H2O.
③装置D中的试剂为浓硫酸.
④已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验,测量数据如表:
| 装置质量 | 实验前/g | 实验后/g |
| B | 22.6 | 42.4 |
| E(不含干燥管) | 80.2 | 146.2 |
(4)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,与青蒿素化学性质相似的物质是C(填字母代号).
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖.
(1)用固体NaHCO3配置饱和NaHCO3溶液的操作过程在烧杯中加入足量碳酸氢钠固体,加入适量蒸馏水,加热使之溶解,冷却后取上层清液即可.饱和NaHCO3溶液pH=8.4,用离子方程式表示HCO3-+H2O?H2CO3+OH-.
(2)请完成以下实验设计(镁条已擦去氧化膜且表面积大致相同.表中不要留空格):
序号 | 实验操作 | 实验现象 | 实验结论 |
| 1 | 将镁条投入5ml蒸馏水 | 微量气泡 | |
| 2 | 将镁条投入5ml饱和NaHCO3溶液中 | Mg与NaHCO3溶液剧烈反应 | |
| 3 | 将镁条投入5ml pH=8.4NaOH溶液中 | 现象不明显 | Mg与NaOH溶液较难反应 |
假设一:只有CO2;假设二:只有H2;假设三:H2和CO2
为检验其中是否含有CO2,写出实验步骤和结论.
实验步骤 | 想象和结论 |
| 大试管中加入擦去氧化膜的镁条 加入碳酸氢钠饱和溶液,用湿润的红色石蕊试纸在锥形瓶口检验 | 若试纸变红,气体中有CO2若试纸不变红,气体中无CO2 |
| A. | X、Z、W均可形成两种常见氧化物 | |
| B. | 四种元素在自然界均不能以游离态存在 | |
| C. | 元素X、Y、W的最高化合价均与其族序数相等 | |
| D. | 离子半径:W>Z>Y |
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)①、③、⑤的最高价最高价氧化物对应的水化物中,碱性最强的是NaOH (填化学式);
(3)②、③、④三种元素可形成的离子,离子半径由大到小的顺序为K+>Ca2+>Mg2+(请填离子符号);
(4)①和⑨两元素形成化合物灼烧时的焰色为黄 色;该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=2Cl-+Br2.
