题目内容
下列化学用语表达不正确的是( )
A、二氧化碳的电子式: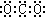 |
| B、水分子的结构式:H-O-H |
C、乙烯的比例模型: |
| D、碳酸氢钠溶于水的电离方程式:NaHCO3=Na++HCO3- |
考点:电子式、化学式或化学符号及名称的综合
专题:化学用语专题
分析:A.碳与氧之间是双键;
B.结构式是表示用元素符号和短线表示化合物(或单质)分子中原子的排列和结合方式的式子;
C.比例模型可以直观地表示分子的形状,其碳原子的成键情况是确定分子结构的关键,碳原子的成键情况主要根据与碳原子形成共价键的原子的数目确定,原子半径的关系为C>O>H;
D.碳酸氢钠是强电解质,完全电离,生成钠离子和碳酸氢根离子.
B.结构式是表示用元素符号和短线表示化合物(或单质)分子中原子的排列和结合方式的式子;
C.比例模型可以直观地表示分子的形状,其碳原子的成键情况是确定分子结构的关键,碳原子的成键情况主要根据与碳原子形成共价键的原子的数目确定,原子半径的关系为C>O>H;
D.碳酸氢钠是强电解质,完全电离,生成钠离子和碳酸氢根离子.
解答:
解:A.CO2为共价化合物,电子式为 ,故A错误;
,故A错误;
B.水分子的结构可表示为H-O-H,故B正确;
C.乙烯的比例模型: ,故C正确;
,故C正确;
D.碳酸氢钠属于强电解质,电离方程式为:NaHCO3=Na++HCO3-,故D正确.
故选A.
 ,故A错误;
,故A错误; B.水分子的结构可表示为H-O-H,故B正确;
C.乙烯的比例模型:
 ,故C正确;
,故C正确;D.碳酸氢钠属于强电解质,电离方程式为:NaHCO3=Na++HCO3-,故D正确.
故选A.
点评:本题考查电子式、结构式、比例模型和电离方程式,C为易错点,明确模型中碳、氢、氧原子的大小及个数是解答本题的关键.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
某溶液中含有NO
、SO
、AlO
、S2-等四种阴离子,若向其中加入过量的盐酸溶液,微热并搅拌,再加入过量的NaOH溶液,则溶液中的阴离子数目一定不改变是( )
- 3 |
2- 4 |
- 2 |
A、NO
| ||
B、SO
| ||
| C、S2- | ||
D、AlO
|
化学键使得一百多种元素构成了世界的万事万物,关于化学键的下列叙述中,正确的是( )
| A、离子化合物一定含有共价键,共价化合物中不含离子键 |
| B、共价化合物可能含离子键,离子化合物中只含离子键 |
| C、构成单质分子的粒子一定含有共价键 |
| D、在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用 |
下列离子方程式书写正确的是( )
| A、常温下氯气与水反应:Cl2+H2O══Cl-+ClO-+2 H+ |
| B、AlCl3溶液中加入足量的氨水:Al3++3NH3?H2O══Al(OH)3↓+3NH4+ |
| C、铁与稀硝酸反应:Fe+2H+══Fe2++H2↑ |
| D、大理石与盐酸反应:2H++CO32-══H2O+CO2↑ |
在25℃时,NH4+浓度相等的NH4Cl、CH3COONH4、NH4HSO4、NH4Fe(SO4)2的溶液中,其对应溶液中溶质的物质的量浓度分别为a、b、c、d(单位为mol/L),下列判断正确的是( )
| A、a=b=c=d |
| B、a=c>b=d |
| C、b>a>d>c |
| D、c>d>a>b |
下列做法符合食品安全要求的是( )
| A、在食盐中加适量乳酸锌以防止儿童缺锌 |
| B、用聚氯乙烯(PVC)材料作为食品保鲜膜 |
| C、制作膨化食品时可加入过量的膨松剂硫酸铝铵 |
| D、加工香肠时可加入过量的亚硝酸钠使其呈现亮红的颜色 |
下列关系错误的是( )
| A、熔点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 |
| B、含氢量:甲烷>乙烯>乙炔>苯 |
| C、密度:CCl4>CHCl3>H2O>苯 |
| D、同物质的量物质燃烧耗O2量:已烷>环已烷>苯>乙炔 |
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,22.4L CHCl3中含有氯原子数目为3NA |
| B、7g CnH2n中含有的氢原子数目为NA |
| C、18g D2O中含有的质子数目为10NA |
| D、0.5mol/L Na2CO3 溶液中含有的Na+数目为1NA |