题目内容
下列离子方程式书写正确的是( )
| A、常温下氯气与水反应:Cl2+H2O══Cl-+ClO-+2 H+ |
| B、AlCl3溶液中加入足量的氨水:Al3++3NH3?H2O══Al(OH)3↓+3NH4+ |
| C、铁与稀硝酸反应:Fe+2H+══Fe2++H2↑ |
| D、大理石与盐酸反应:2H++CO32-══H2O+CO2↑ |
考点:离子方程式的书写
专题:
分析:A、氯气和水反应生成的次氯酸是弱酸存在电离平衡;
B、氯化铝和过量氨水反应生成氢氧化铝沉淀和氯化铵;
C、铁和稀硝酸反应生成硝酸铁,一氧化氮和水;
D、碳酸钙难溶于水;
B、氯化铝和过量氨水反应生成氢氧化铝沉淀和氯化铵;
C、铁和稀硝酸反应生成硝酸铁,一氧化氮和水;
D、碳酸钙难溶于水;
解答:
解:A、常温下氯气与水反应的离子方程式:Cl2+H2O═Cl-+HClO+H+,故A错误;
B、AlCl3溶液中加入足量的氨水反应生成氢氧化铝沉淀和氯化铵:Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故B正确;
C、铁与稀硝酸反应生成硝酸铁、一氧化氮和水,反应的离子方程式:Fe+NO3-+4H+═Fe3++2H2O+NO↑,故C错误;
D、大理石与盐酸反应:2H++CaCO3═H2O+CO2↑+Ca2+,故D错误;
故选B.
B、AlCl3溶液中加入足量的氨水反应生成氢氧化铝沉淀和氯化铵:Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故B正确;
C、铁与稀硝酸反应生成硝酸铁、一氧化氮和水,反应的离子方程式:Fe+NO3-+4H+═Fe3++2H2O+NO↑,故C错误;
D、大理石与盐酸反应:2H++CaCO3═H2O+CO2↑+Ca2+,故D错误;
故选B.
点评:本题考查了离子方程式书写方法和注意问题,主要是弱电解质和物质溶解性分析判断,掌握基础是关键,题目较简单.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A、28g氮气所含有的原子数目为NA |
| B、2.4g金属镁变成镁离子时失去的电子数目为0.1NA |
| C、22.4L甲烷的质量与NA个甲烷分子的质量之和相等 |
| D、标准状况下,22.4LN2和O2混合物所含的分子数为NA |
下列物质中含有共价键的离子化合物是( )
| A、CaC2 |
| B、MgCl2 |
| C、SiO2 |
| D、C2H4 |
下列说法正确的是( )
| A、第ⅠA族金属单质的密度、熔沸点均随着核电荷数的增大而递增 |
| B、金属锂在氧气中燃烧生成Li2 O2 |
| C、金属的还原性:Li>Na>K>Rb |
| D、氢化物的稳定性:HF>HCl>HBr>HI |
在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应认识不正确的是( )
| 物质 | M | N | Q | P |
| 反应前质量(g) | 18 | 1 | 2 | 32 |
| 反应后质量(g) | X | 26 | 2 | 12 |
| A、该变化的基本反应类型是分解反应 |
| B、反应后物质M的质量为l3g |
| C、反应中N、P的质量比为5:4 |
| D、物质Q可能是该反应的催化剂 |
已知某元素最高价氧化物的对应水化物的化学式为H2XO3则其氢化物为( )
| A、H4X |
| B、XH4 |
| C、HX |
| D、H2X |
下列化学用语表达不正确的是( )
A、二氧化碳的电子式: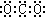 |
| B、水分子的结构式:H-O-H |
C、乙烯的比例模型: |
| D、碳酸氢钠溶于水的电离方程式:NaHCO3=Na++HCO3- |
下列有关碱金属铷(Rb)的叙述中,正确的是( )
| A、灼烧氯化铷时,火焰有特殊颜色 |
| B、硝酸铷是离子化合物,不易溶于水 |
| C、在钠、钾、铷三种单质中,铷的熔点最高 |
| D、氢氧化铷是弱碱 |
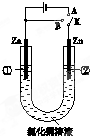 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按图连接.
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按图连接.