题目内容
某溶液中含有NO
、SO
、AlO
、S2-等四种阴离子,若向其中加入过量的盐酸溶液,微热并搅拌,再加入过量的NaOH溶液,则溶液中的阴离子数目一定不改变是( )
- 3 |
2- 4 |
- 2 |
A、NO
| ||
B、SO
| ||
| C、S2- | ||
D、AlO
|
考点:离子反应发生的条件
专题:离子反应专题
分析:根据离子与盐酸、氢氧化钠发生的反应进行判断.
解答:
解:混合溶液中加入过量盐酸溶液,S2-被硝酸氧化,生成硫酸根离子,故NO
、S2-会减少,SO
会增加;AlO
与盐酸反应,生成氯化铝,再加入过量的NaOH溶液,氯化铝与氢氧化钠反应生成AlO
,故AlO
数目没有发生改变,
故选D.
- 3 |
2- 4 |
- 2 |
- 2 |
- 2 |
故选D.
点评:本题考查离子之间的反应,难度中等.明确阴离子与盐酸反应后的生成物的性质及生成物与氢氧化钠的反应是解答本题的关键.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
下列元素中,属于第二周期的是( )
| A、氢 | B、氧 | C、钠 | D、氯 |
下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A、28g氮气所含有的原子数目为NA |
| B、2.4g金属镁变成镁离子时失去的电子数目为0.1NA |
| C、22.4L甲烷的质量与NA个甲烷分子的质量之和相等 |
| D、标准状况下,22.4LN2和O2混合物所含的分子数为NA |
可以证明乙醇分子中有一个氢原子与另外氢原子不同的方法是( )
| A、1 mol乙醇燃烧生成3 mol水 |
| B、1 mol乙醇可以生成1 mol乙醛 |
| C、1 mol乙醇跟足量的钠反应得到0.5 mol H2 |
| D、乙醇与水能以任意比互溶 |
下列离子方程式不正确的是( )
| A、硫酸铝溶液跟偏铝酸钠溶液反应:Al3++3AlO2-+6H2O=4Al(OH)3↓ |
| B、碳酸钙跟醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
| C、次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
| D、小苏打溶液跟烧碱溶液反应:HCO3-+OH-=CO32-+H2O |
下列各组比较不正确的是( )
| A、酸性:H4SiO4<H3PO4<H2SO4<HClO4 |
| B、碱性:Be(OH)2<Mg(OH)2<KOH |
| C、氧化性:S<O2<F2 |
| D、还原性:Se2-<S2-<O2- |
下列物质中含有共价键的离子化合物是( )
| A、CaC2 |
| B、MgCl2 |
| C、SiO2 |
| D、C2H4 |
下列化学用语表达不正确的是( )
A、二氧化碳的电子式: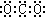 |
| B、水分子的结构式:H-O-H |
C、乙烯的比例模型: |
| D、碳酸氢钠溶于水的电离方程式:NaHCO3=Na++HCO3- |