题目内容
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,22.4L CHCl3中含有氯原子数目为3NA |
| B、7g CnH2n中含有的氢原子数目为NA |
| C、18g D2O中含有的质子数目为10NA |
| D、0.5mol/L Na2CO3 溶液中含有的Na+数目为1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、标准状况,CHCl3不是气体;
B、依据n=
计算物质的量,结合分子式计算氢原子数;
C、依据n=
计算物质的量,结合分子式计算质子数;
D、溶液体积不知不能计算微粒数.
B、依据n=
| m |
| M |
C、依据n=
| m |
| M |
D、溶液体积不知不能计算微粒数.
解答:
解:A、标准状况,CHCl3不是气体,22.4L CHCl3中物质的量不是1mol,故A错误;
B、依据n=
计算物质的量=
,结合分子式计算氢原子数=
×2n×NA=NA,故B正确;
C、依据n=
计算物质的量=
=0.9mol,结合分子式计算质子数=0.9mol×(2+8)×NA=9NA,故C错误;
D、溶液体积不知不能计算微粒数,故D错误;
故选B.
B、依据n=
| m |
| M |
| 7g |
| 14ng/mol |
| 7g |
| 14ng/mol |
C、依据n=
| m |
| M |
| 18g |
| 20g/mol |
D、溶液体积不知不能计算微粒数,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件分析,物质的量计算微粒数,题目较简单.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
下列物质中含有共价键的离子化合物是( )
| A、CaC2 |
| B、MgCl2 |
| C、SiO2 |
| D、C2H4 |
下列化学用语表达不正确的是( )
A、二氧化碳的电子式: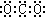 |
| B、水分子的结构式:H-O-H |
C、乙烯的比例模型: |
| D、碳酸氢钠溶于水的电离方程式:NaHCO3=Na++HCO3- |
下列有关碱金属铷(Rb)的叙述中,正确的是( )
| A、灼烧氯化铷时,火焰有特殊颜色 |
| B、硝酸铷是离子化合物,不易溶于水 |
| C、在钠、钾、铷三种单质中,铷的熔点最高 |
| D、氢氧化铷是弱碱 |
下列物质不互为同分异构体的一组是( )
| A、葡萄糖和果糖 |
| B、正丁烷和异丁烷 |
C、 和 和 |
| D、CH3CH2OH和CH3OCH3 |
下列化合物中,化学键的类型和分子的极性(极性或非极性)皆相同的是( )
| A、CO2和SO2 |
| B、CH4和SiO2 |
| C、BF3和NH3 |
| D、HCl和HI |
实验室用铅蓄电池作电源电解饱和食盐水制取氯气.已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42--2e-=PbSO4 正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
今若制取0.25mol Cl2,这时电池内消耗的H2SO4的物质的量至少是( )
负极:Pb+SO42--2e-=PbSO4 正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
今若制取0.25mol Cl2,这时电池内消耗的H2SO4的物质的量至少是( )
| A、0.25 mol |
| B、0.35 mol |
| C、0.50mol |
| D、0.75mol |
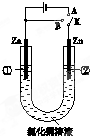 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按图连接.
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按图连接.