题目内容
下列说法正确的是( )
| A、已知2H2(g)+O2(g)=2H2O(g),△H=-483.6kJ?mol-1,则H2的燃烧热为-241.8kJ?mol-1 | ||||||||||
B、已知:25℃时,
| ||||||||||
C、反应Fe(s)+5CO(g)?Fe(CO)5(g)的平衡常数表达式为K=
| ||||||||||
D、0.1mol?L-1的酒石酸(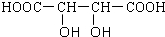 )与0.1mol?L-1的NaOH混合后:c(HC4H4O6-)+2c(C4H4O62-)=c(Na+)+c(H+)-c(OH-) )与0.1mol?L-1的NaOH混合后:c(HC4H4O6-)+2c(C4H4O62-)=c(Na+)+c(H+)-c(OH-) | ||||||||||
考点:反应热和焓变,化学平衡常数的含义,弱电解质在水溶液中的电离平衡,离子浓度大小的比较
专题:基本概念与基本理论
分析:A、氢气的燃烧热是生成液态水时放出的热量;
B、草酸的K2>碳酸的K1,即HC2O4-的酸性比碳酸强;
C、Fe是固体,其无浓度变化,不列入化学平衡常数表达式;
D、依据电荷守恒解答.
B、草酸的K2>碳酸的K1,即HC2O4-的酸性比碳酸强;
C、Fe是固体,其无浓度变化,不列入化学平衡常数表达式;
D、依据电荷守恒解答.
解答:
解:A、燃烧热必须是可燃物完全燃烧放出的热量,生成液态水,故A错误;
B、草酸的K2>碳酸的K1,即HC2O4-的酸性比碳酸强,反应方程式应为:H2C2O4+2HCO3-═C2O42-+2H2O+2CO2↑,故B错误;
C、固体和纯液体浓度为常数,不列入化学平衡常数表达式,Fe不列入,故C错误;
D、依据电荷守恒,有c(HC4H4O6-)+2c(C4H4O62-)+c(OH-)=c(Na+)+c(H+),故D正确.
故选:D.
B、草酸的K2>碳酸的K1,即HC2O4-的酸性比碳酸强,反应方程式应为:H2C2O4+2HCO3-═C2O42-+2H2O+2CO2↑,故B错误;
C、固体和纯液体浓度为常数,不列入化学平衡常数表达式,Fe不列入,故C错误;
D、依据电荷守恒,有c(HC4H4O6-)+2c(C4H4O62-)+c(OH-)=c(Na+)+c(H+),故D正确.
故选:D.
点评:本题考查燃烧热、弱酸的K与酸性强弱的关系、化学平衡常数表达式书写、电解质溶液中的电荷守恒等等,题目难度不大.

练习册系列答案
相关题目
体积相同、pH值相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌已经全部溶解且放出气体一样多,为此下列说法正确的是( )
| A、反应开始时的速率:甲>乙 |
| B、反应所需时间:甲<乙 |
| C、反应开始时,酸的物质的量浓度:甲>乙 |
| D、反应结束时,pH:甲>乙 |
氢氰酸(HCN)的下列性质中,不能证明它是弱电解质的是( )
| A、1 mol/L氢氰酸溶液的pH约为3 |
| B、常温下,pH=a的HCN稀释100倍后所得溶液pH<(a+2)[(a+2)<7] |
| C、10mL 1mol/L HCN恰好与10mL 1mol/L NaOH溶液完全反应 |
| D、NaCN溶液呈碱性 |
下列气体有毒的是( )
| A、N2 |
| B、H2 |
| C、O2 |
| D、Cl2 |
在C2H4、C2H4O组成的混合物中,已知碳元素的质量分数为72%,则混合物中氧元素的质量分数是( )
| A、6% | B、12% |
| C、16% | D、20% |
下列物质中,肯定能发生化学反应而使溴的CCl4溶液和酸性高锰酸钾溶液褪色的( )
| A、甲苯 |
| B、C3H6 |
| C、C5H12 |
| D、C2H4 |
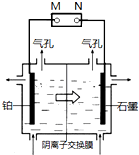 制备单质锰的实验装置如图,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中箭头表示溶液中阴离子移动的方向.下列说法不正确的是( )
制备单质锰的实验装置如图,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中箭头表示溶液中阴离子移动的方向.下列说法不正确的是( )| A、M是电源的负极 | ||||
| B、左侧气孔逸出的气体可能为副产物H2 | ||||
C、电解槽中发生的总反应为:MnSO4+2H2O
| ||||
| D、若用阳离子交换膜代替阴离子交换膜,阳极可能得到 MnO2 |
下列离子方程式正确的是( )
| A、铁和盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、氯化铁和铜反应:Fe3++Cu=Fe2++Cu2+ |
| C、澄清石灰水与碳酸钠溶液混合:Ca(OH)2+CO32-=CaCO3↓+2OH- |
| D、用醋酸除水垢:2CH3COOH+CaCO3=2CH3COO-+Ca2++H2O+CO2↑ |
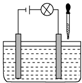 在如图所示电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液时,则灯光由亮变暗至熄灭后又逐渐变亮的是( )
在如图所示电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液时,则灯光由亮变暗至熄灭后又逐渐变亮的是( )| A、盐酸中逐滴加入食盐溶液 |
| B、醋酸中逐滴加入氢氧化钠溶液 |
| C、饱和石灰水中不断通入CO2 |
| D、醋酸中逐滴加入氨水 |