题目内容
体积相同、pH值相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌已经全部溶解且放出气体一样多,为此下列说法正确的是( )
| A、反应开始时的速率:甲>乙 |
| B、反应所需时间:甲<乙 |
| C、反应开始时,酸的物质的量浓度:甲>乙 |
| D、反应结束时,pH:甲>乙 |
考点:弱电解质在水溶液中的电离平衡,溶液pH的定义
专题:电离平衡与溶液的pH专题
分析:pH相同的盐酸(甲)和醋酸(乙),则两种溶液中氢离子浓度相等,反应速率和离子浓度成正比,醋酸是弱电解质,氯化氢是强电解质,所以c(HCl)<c(CH3COOH),若最后锌粒全部溶解且放出气体一样多,可能是盐酸恰好反应而醋酸过量,也可能是盐酸和醋酸都过量,以此解答该题.
解答:
解:A.pH相同的盐酸(甲)和醋酸(乙),两种溶液中氢离子浓度相等,所以开始反应速率相等,故A错误;
B.反应过程中,醋酸电离导致醋酸中氢离子浓度减少速率小于盐酸中氢离子浓度减少速率,盐酸中的氢离子浓度小于醋酸中氢离子浓度,盐酸反应速率小于醋酸,所以反应所需时间:甲>乙,故B错误;
C.pH相同的盐酸(甲)和醋酸(乙),醋酸是弱电解质,氯化氢是强电解质,所以C(HCl)<C(CH3COOH),等体积的盐酸和醋酸,n(HCl)<n(CH3COOH),故C错误;
D.若最后锌粒全部溶解且放出气体一样多,可能是盐酸恰好反应而醋酸过量,也可能是盐酸和醋酸都过量,如果盐酸恰好反应而醋酸过量,则反应后溶液的PH甲>乙,如果盐酸和醋酸都过量,因生成的锌离子的物质的量相同,且醋酸浓度大于盐酸,则反应后醋酸溶液氢离子浓度仍大于盐酸,pH较小,故D正确.
故选D.
B.反应过程中,醋酸电离导致醋酸中氢离子浓度减少速率小于盐酸中氢离子浓度减少速率,盐酸中的氢离子浓度小于醋酸中氢离子浓度,盐酸反应速率小于醋酸,所以反应所需时间:甲>乙,故B错误;
C.pH相同的盐酸(甲)和醋酸(乙),醋酸是弱电解质,氯化氢是强电解质,所以C(HCl)<C(CH3COOH),等体积的盐酸和醋酸,n(HCl)<n(CH3COOH),故C错误;
D.若最后锌粒全部溶解且放出气体一样多,可能是盐酸恰好反应而醋酸过量,也可能是盐酸和醋酸都过量,如果盐酸恰好反应而醋酸过量,则反应后溶液的PH甲>乙,如果盐酸和醋酸都过量,因生成的锌离子的物质的量相同,且醋酸浓度大于盐酸,则反应后醋酸溶液氢离子浓度仍大于盐酸,pH较小,故D正确.
故选D.
点评:本题考查了弱电解质的电离,为高频考点,侧重于学生的分析能力的考查,注意根据影响反应速率的因素、弱电解质电离特点、物质的性质等知识点来分析解答,反应速率与离子浓度有关,与电解质强弱无关,为易错点.

练习册系列答案
相关题目
等质量的铜片在酒精灯上热后,分别插入下列液体中,放置片刻后取出,铜片质量不变的是( )
| A、盐酸 | B、乙醇 | C、醋酸 | D、乙醛 |
 蒽与苯炔
蒽与苯炔 反应生成化合物X,X中的一个氢原子被甲基取代,所得取代产物的所有同分异构体数为( )
反应生成化合物X,X中的一个氢原子被甲基取代,所得取代产物的所有同分异构体数为( )| A、2种 | B、3种 | C、4种 | D、5种 |
下面关于原电池的说法,正确的是( )
| A、在正极上发生氧化反应 |
| B、化学性质较活泼的一极为负极 |
| C、在外电路中电子流出的极为正极 |
| D、原电池是将电能转化为化学能的装置 |
某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则该溶液中( )
A、一定有SO
| ||||
B、SO
| ||||
| C、一定无Ag+ | ||||
D、可能有CO
|
下列离子方程式中正确的是( )
| A、澄清石灰水与稀盐酸反应Ca(OH)2+2H+═Ca2++2H2O |
| B、氢氧化钡与硫酸反应OH-+H+═H2O |
| C、铜片插入硝酸银溶液中Cu+Ag+═Cu2++Ag |
| D、氯化镁溶液与氢氧化钠溶液反应Mg2++2OH-═Mg(OH)2↓ |
下列叙述不正确的是( )
| A、某溶液中只含Na+、CH3COO-、H+、OH-四种离子,则溶液一定呈现碱性 |
| B、在Na2SO3和NaHSO3混合液中:c(Na+)+c(H+)=c(HSO3-)+c(OH-)+2c(SO32-) |
| C、相同条件下,pH=10的CH3COONa溶液和氨水中,由水电离出的c(OH-)前者大于后者 |
| D、相同物质的量浓度的①CH3COONa溶液②NaNO3溶液③NH4Cl溶液④NaOH溶液,pH的大小顺序是:④>①>②>③ |
下列说法正确的是( )
| A、已知2H2(g)+O2(g)=2H2O(g),△H=-483.6kJ?mol-1,则H2的燃烧热为-241.8kJ?mol-1 | ||||||||||
B、已知:25℃时,
| ||||||||||
C、反应Fe(s)+5CO(g)?Fe(CO)5(g)的平衡常数表达式为K=
| ||||||||||
D、0.1mol?L-1的酒石酸(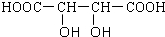 )与0.1mol?L-1的NaOH混合后:c(HC4H4O6-)+2c(C4H4O62-)=c(Na+)+c(H+)-c(OH-) )与0.1mol?L-1的NaOH混合后:c(HC4H4O6-)+2c(C4H4O62-)=c(Na+)+c(H+)-c(OH-) | ||||||||||