题目内容
在C2H4、C2H4O组成的混合物中,已知碳元素的质量分数为72%,则混合物中氧元素的质量分数是( )
| A、6% | B、12% |
| C、16% | D、20% |
考点:元素质量分数的计算
专题:计算题
分析:C2H4、C2H4O组成的混合物中,C、H原子数目之比为定值1:2,故C、H元素质量之比为6:1,结合碳元素质量分数计算混合物中H元素质量分数,进而计算混合物中氧元素质量分数.
解答:
解:C2H4、C2H4O组成的混合物中,C、H原子数目之比为定值1:2,故C、H元素质量之比为12:2=6:1,混合物中碳元素质量分数为72%,则混合物中H元素质量分数=72%×
=12%,故混合物中氧元素质量分数为1-72%-12%=16%,
故选C.
| 1 |
| 6 |
故选C.
点评:本题考查质量分数计算,难度不大,根据化学式确定混合物中C、H元素质量之比是关键.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
下面关于原电池的说法,正确的是( )
| A、在正极上发生氧化反应 |
| B、化学性质较活泼的一极为负极 |
| C、在外电路中电子流出的极为正极 |
| D、原电池是将电能转化为化学能的装置 |
下列液体均处于25℃,有关叙述正确的是( )
| A、某物质的溶液pH<7,向该溶液中加入氢氧化钠溶液,Kw增大 |
| B、pH=8的NaOH溶液稀释100倍,其pH=6 |
| C、将1L 0.1mol?L-1的Ba(OH)2溶液稀释为2L,pH=12 |
| D、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
 对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )①Zn是负极
②电子由Zn经外电路流向Cu
③Zn-2e-=Zn2+
④溶液中H+向Zn棒迁移.
| A、①② | B、①②③ |
| C、②③④ | D、①②③④ |
下列离子在碱性溶液中能大量共存,并且溶液为无色透明的是( )
A、Al3+,K+,CO
| ||||
B、Na+,Ba2+,Cl-,NO
| ||||
C、Na+,Cl-,Ca2+,MnO
| ||||
D、K+,H+,SO
|
下列说法正确的是( )
| A、已知2H2(g)+O2(g)=2H2O(g),△H=-483.6kJ?mol-1,则H2的燃烧热为-241.8kJ?mol-1 | ||||||||||
B、已知:25℃时,
| ||||||||||
C、反应Fe(s)+5CO(g)?Fe(CO)5(g)的平衡常数表达式为K=
| ||||||||||
D、0.1mol?L-1的酒石酸(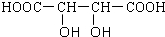 )与0.1mol?L-1的NaOH混合后:c(HC4H4O6-)+2c(C4H4O62-)=c(Na+)+c(H+)-c(OH-) )与0.1mol?L-1的NaOH混合后:c(HC4H4O6-)+2c(C4H4O62-)=c(Na+)+c(H+)-c(OH-) | ||||||||||
下列有关晶体的叙述中,错误的是( )
| A、金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 |
| B、氯化钠晶体中,每个Na+周围距离相等且最近的Na+共有6个 |
| C、金属晶体中,以“…ABCABCABC…”形式的堆积称为面心立方堆积 |
| D、干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子共有12个 |
下列说法不正确的是( )
| A、50mL 三种气态混合烃与足量氧气混合点燃爆炸后,恢复到原来的状态(常温常压下),体积共缩小100mL,则三种烃可能是C2H4、C2H6、C2H2 |
| B、A、B两种有机物组成混合物,当混合物的质量相等时,无论A、B以何种比例混合,完全燃烧产生CO2的量均相等,符合这一组合的条件A、B两物质可能互为同系物 |
| C、等物质的量的烃或烃的含氧衍生物A和B完全燃烧时,消耗氧气的量相等,则A和B的分子量相差只可能为18n、44n (n为正整数) |
| D、燃烧等质量的烃,耗氧量最多的一定是甲烷 |
下列说法正确的是( )
| A、用玻璃棒蘸取待测样品溶液于无色火焰上灼烧,焰色为黄色,说明样品含钠元素 |
| B、将移液管中液体放出时,移液管不能与容器内壁接触,以免污染试剂 |
| C、可以用蒸馏水润湿的pH试纸检验氨气 |
| D、检验红色砖块中是否含三价铁的步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |