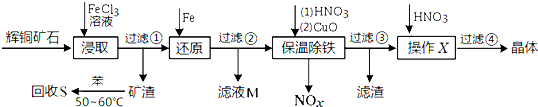
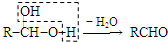题目内容
根据题目完成下列各小题:一定温度下,两种酸:a、盐酸 b、醋酸:
①当两种酸的物质的量浓度相同时,c(H+):a b(填“>”、“<”或“=”,下同)
②在pH相同、体积相同的两种酸溶液中加入过量的铁粉,反应结束时生成H2的总体积:a b.
③将pH相同,体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a b.
①当两种酸的物质的量浓度相同时,c(H+):a
②在pH相同、体积相同的两种酸溶液中加入过量的铁粉,反应结束时生成H2的总体积:a
③将pH相同,体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a
考点:弱电解质在水溶液中的电离平衡,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:①盐酸为强酸,醋酸为弱酸;
②同体积同pH的两种酸,醋酸的物质的量浓度远远大于盐酸;
③当c(H+)相同、体积相同时,盐酸完全电离,加水稀释时只有醋酸继续电离.
②同体积同pH的两种酸,醋酸的物质的量浓度远远大于盐酸;
③当c(H+)相同、体积相同时,盐酸完全电离,加水稀释时只有醋酸继续电离.
解答:
解:①盐酸为强酸,醋酸为弱酸,则质的量浓度相同时,c(H+)由大到小的顺序是a>b,故答案为:>;
②同体积同pH的两种酸,醋酸的物质的量浓度远远大于盐酸,加入过量的铁粉,醋酸产生的氢气多,故答案为:<;
③当c(H+)相同、体积相同时,盐酸完全电离,只有醋酸在继续电离,加水稀释时,盐酸的pH变化大,醋酸的pH小,故答案为:>.
②同体积同pH的两种酸,醋酸的物质的量浓度远远大于盐酸,加入过量的铁粉,醋酸产生的氢气多,故答案为:<;
③当c(H+)相同、体积相同时,盐酸完全电离,只有醋酸在继续电离,加水稀释时,盐酸的pH变化大,醋酸的pH小,故答案为:>.
点评:本题考查强弱电解质的本质区别,题目难度中等,注意强弱电解质的比较和影响电离平衡移动的因素,注重基础知识的积累.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
设NA表示阿伏加德罗常数值,下列叙述正确的是( )
| A、常温常压下,56 g Fe与足量的盐酸完全反应转移的电子数为3NA |
| B、标准状态下,11.2 L氯气含有分子数为0.5 NA |
| C、0.1 mol?L-1的硫酸铝溶液所含的SO42-数就是0.3NA |
| D、NA个He分子所具有的体积为22.4L |
几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期.下列叙述不正确的是( )
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
| A、离子半径大小:R3+<X+<M2- |
| B、Y与M组成的化合物是光化学烟雾的原因之一 |
| C、将YM2通入Ba(NO3)2溶液中有大量白色沉淀产生 |
| D、M氢化物的熔沸点高于Z氢化物的熔沸点 |
下列离子方程式正确的是( )
| A、三氯化铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ |
| B、向含有0.2 mol FeI2的溶液中通入0.25 mol Cl2:8I-+2Fe2++5Cl2═10Cl-+4I2+2Fe3+ |
| C、K37ClO3与浓盐酸(HCl)在加热时生成Cl2:37ClO3-+6HCl═37Cl-+3Cl2↑+3H2O |
| D、将0.1 mol/L盐酸数滴缓缓滴入0.1 mol/L 25 mL Na2CO3溶液中,并不断搅拌:2H++CO32-═CO2↑+H2O |
下列各组离子在溶液中能大量共存的是( )
| A、H+、Cl-、CH3COO-、NO3- |
| B、K+、AlO2-、NO3-、OH- |
| C、Fe3+、I-、SO42-、H+ |
| D、AlO2-、HCO3-、Na+、K+ |
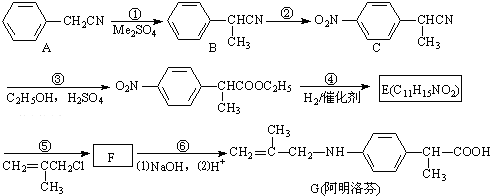
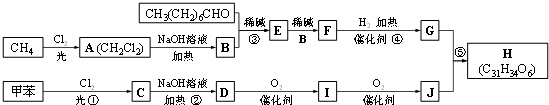
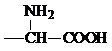 ②含有对位二取代苯环
②含有对位二取代苯环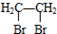
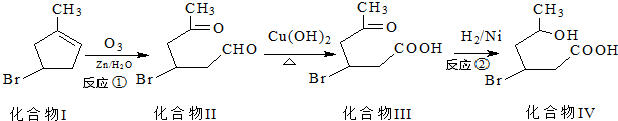
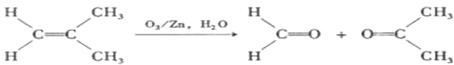
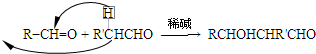
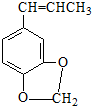 )发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为
)发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为