题目内容
14.实验室拟制备纯净的氯气并回收剩余药品,下列图示装置和原理能达到实验目的是( )| A. |  制备Cl2 | B. | 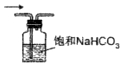 去除杂质 | C. |  干燥Cl2 | D. |  回收固体MnO2 |
分析 A.浓盐酸与二氧化锰反应需要加热;
B.氯气、HCl均与饱和碳酸氢钠反应;
C.氯气与碱石灰反应;
D.二氧化锰不溶于水.
解答 解:A.浓盐酸与二氧化锰反应需要加热,图中缺少酒精灯,不能制备,故A错误;
B.氯气、HCl均与饱和碳酸氢钠反应,不能除杂,应选饱和食盐水,故B错误;
C.氯气与碱石灰反应,不能干燥,应选无水氯化钙,故C错误;
D.二氧化锰不溶于水,则图中过滤装置可回收二氧化锰,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、物质的制备实验、混合物分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
2.短周期元素X、Y、Z、W在元素周期表中的相对位置关系如图所示.下列判断正确的是( )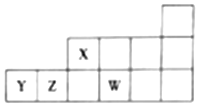

| A. | 原子半径:rW>rZ>rY>rX | |
| B. | 最高价氧化物对应水化物的酸性:Z>X>Y | |
| C. | X、Z、W形成的简单氢化物中X的氢化物沸点最高 | |
| D. | W与Y元素形成的化合物在水溶液中能稳定存在 |
9.下列说法正确的是( )
| A. | pH=3的盐酸与pH=11的氨水等体积混合后,溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 升高NH4Cl溶液的温度,其水的离子积常数和pH均增大 | |
| C. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H>0 | |
| D. | 常温下0.1mol/L的Na2A溶液pH=10,该溶液中水电离的c(OH-)=10-10mol/L |
19.化学与生活密切相关.下列有关说法错误的是( )
| A. | SiO2、MgO熔点高,可用于制作耐高温材料 | |
| B. | 天然气是可再生清洁能源,可用于工业制盐酸 | |
| C. | 硝酸铵属于氧化剂,严禁用可燃物(如纸袋)包装 | |
| D. | “一带一路”是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称.丝绸的主要成分是蛋白质,属于高分子化合物 |
6.实验是化学研究的基础,下列实验设计原理正确的是( )

| A. | 装置①:可用于吸收NH3,并防止倒吸 | |
| B. | 装置②:验证溴乙烷发生消去反应生成烯烃 | |
| C. | 装置③:观察原电池装置中电流表指针偏转 | |
| D. | 装置④:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH |
8.化学与生产、生活、社会密切相关.下列说法中不正确的是( )
| A. | “硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致. | |
| B. | 加入Na2S可消除污水中Hg2+的污染 | |
| C. | 氮的氧化物是光化学烟雾的主要污染物,二氧化碳是温室效应的主要污染物,所以它们的含量是空气质量报告的主要项目 | |
| D. | 有机玻璃是以有机物A(甲基丙烯酸甲酯)为单体,通过加聚反应得到,合成A的一种途经是:CH3C≡CH+CO+CH3OH$\stackrel{Pd}{→}$ ,其过程符合绿色化学的原则 ,其过程符合绿色化学的原则 |
