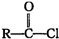
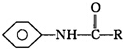
题目内容
下列四组实验中现象或结论不正确的是( )


| 序号 | 实验现象 | 结 论 |
| A | 热水中平衡球颜色比冷水中深 | 升温,化学平衡向吸热反应方向移动 |
| B | 起始时产生气泡速率HCl>CH3COOH | 醋酸是弱电解质 |
| C | 溶液颜色由黄变橙,且30秒内不变色 | 已达滴定终点 |
| D | 划口处有蓝色沉淀 | 铁发生了析氢腐蚀 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.正反应为放热反应,升高温度,平衡逆向移动,颜色加深;
B.等浓度的盐酸和醋酸,开始时盐酸中氢离子浓度大;
C.酸滴定碱,开始碱溶液中加甲基橙为黄色,滴定终点使黄色变为橙色;
D.由图可知,Zn失去电子,发生吸氧腐蚀.
B.等浓度的盐酸和醋酸,开始时盐酸中氢离子浓度大;
C.酸滴定碱,开始碱溶液中加甲基橙为黄色,滴定终点使黄色变为橙色;
D.由图可知,Zn失去电子,发生吸氧腐蚀.
解答:
解:A.正反应为放热反应,升高温度,平衡逆向移动,颜色加深,则现象和结论均合理,故A正确;
B.等浓度的盐酸和醋酸,开始时盐酸中氢离子浓度大,则起始时产生气泡速率HCl>CH3COOH,醋酸不能完全电离,为弱电解质,故B正确;
C.酸滴定碱,开始碱溶液中加甲基橙为黄色,滴定终点使黄色变为橙色,且30秒内不变色,则现象和结论均合理,故C正确;
D.由图可知,Zn失去电子,发生吸氧腐蚀,则不能观察到划口处有蓝色沉淀,现象与结论均不合理,故D错误;
故选D.
B.等浓度的盐酸和醋酸,开始时盐酸中氢离子浓度大,则起始时产生气泡速率HCl>CH3COOH,醋酸不能完全电离,为弱电解质,故B正确;
C.酸滴定碱,开始碱溶液中加甲基橙为黄色,滴定终点使黄色变为橙色,且30秒内不变色,则现象和结论均合理,故C正确;
D.由图可知,Zn失去电子,发生吸氧腐蚀,则不能观察到划口处有蓝色沉淀,现象与结论均不合理,故D错误;
故选D.
点评:本题考查化学实验方案的评价,为高频考点,把握平衡移动、电解质的电离、中和滴定及原电池原理为解答的关键,侧化学反应原理及分析应用能力的考查,注意实验的评价性分析,题目难度中等.

练习册系列答案
相关题目
下列各表达式中,属于水解反应的是( )
| A、HCO3-+H2O?H3O++CO32- |
| B、NH4++OH-?NH3?H2O |
| C、HSO3-+H2O?H2SO3+OH- |
| D、H2O+H2O?H3O++OH- |
下列有关实验的操作、原理和现象,不正确的是( )
| A、纸上层析法通常以滤纸作为惰性支持物.滤纸纤维上的羟基具有亲水性,它所吸附的水作固定相 |
| B、重结晶时,溶质的溶解度越大、溶液冷却速度越慢,得到的晶体颗粒越大 |
| C、往海带灰的浸泡液中加入过量的氯水,以保证I-完全氧化为I2 |
| D、将3~4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 |
下列物质的检验或提纯,其结论或方法正确的是( )
| A、某物质中加入BaCl2溶液产生白色沉淀加入稀HNO3后白色沉淀不溶解,说明该溶液中含有Ag+或SO42-中的至少一种 |
| B、CO2混有少量HC1.可用饱和NaHCO3除去 |
| C、Cl2中混有少量HCl可用通入饱和NaCl溶液的方法除去 |
| D、N2混有少量NO2,可用水洗法除去 |
 如图所示,甲、乙为互相串联的两个电解池.请回答
如图所示,甲、乙为互相串联的两个电解池.请回答


 分子中的亲水基是:
分子中的亲水基是: LED晶片在文化传媒中有着广泛的应用.目前市售LED晶片,材质基本以AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.
LED晶片在文化传媒中有着广泛的应用.目前市售LED晶片,材质基本以AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.
 +
+