题目内容
垃圾是放错地方的资源,工业废料也可以再利用.某化学兴趣小组在实验室中用废弃的含铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3).实验方案如下:

(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:
(2)已知Fe(OH)3沉淀的pH是3~4,溶液C通过调节pH可以使Fe3+沉淀完全.下列物质中,可用作调整溶液C的pH的试剂是 (填序号)
A.铜粉 B.氨水 C.氢氧化铜 D.碱式碳酸铜
(3)常温,若溶液C中金属离子均为1mol?L-1,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,pH=4,溶液中c(Fe3+)= ,此时 Cu(OH)2沉淀生成(填“有”或“无”).
(4)将20mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70mL混合,反应的离子方程式为 .
(5)在0.1L的混合酸溶液中,c(HNO3)=2mol?L-1,cH2SO4)=3mol?L-1,将0.3mol的铜放入充分反应后,被还原的HNO3的物质的量为 .
.

(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:
(2)已知Fe(OH)3沉淀的pH是3~4,溶液C通过调节pH可以使Fe3+沉淀完全.下列物质中,可用作调整溶液C的pH的试剂是
A.铜粉 B.氨水 C.氢氧化铜 D.碱式碳酸铜
(3)常温,若溶液C中金属离子均为1mol?L-1,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,pH=4,溶液中c(Fe3+)=
(4)将20mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70mL混合,反应的离子方程式为
(5)在0.1L的混合酸溶液中,c(HNO3)=2mol?L-1,cH2SO4)=3mol?L-1,将0.3mol的铜放入充分反应后,被还原的HNO3的物质的量为
.
考点:探究物质的组成或测量物质的含量,难溶电解质的溶解平衡及沉淀转化的本质
专题:实验探究和数据处理题
分析:(1)铝、铁、铜的合金中只有铝与KOH溶液反应,生成AlO2-和H2;
(2)溶液C通过调节pH可以使Fe3+沉淀完全,加入的物质能消耗氢离子,但是不能引入新的杂质;
(3)根据Ksp[Fe(OH)3]和溶液中氢氧根离子的浓度计算c(Fe3+);Qc与Ksp[Cu(OH)2]的相对大小判断;
(4)将20mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70mL混合,则二者的物质的量之比为2:7,根据物质的量关系写方程式;
(5)根据反应3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O进行判断.
(2)溶液C通过调节pH可以使Fe3+沉淀完全,加入的物质能消耗氢离子,但是不能引入新的杂质;
(3)根据Ksp[Fe(OH)3]和溶液中氢氧根离子的浓度计算c(Fe3+);Qc与Ksp[Cu(OH)2]的相对大小判断;
(4)将20mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70mL混合,则二者的物质的量之比为2:7,根据物质的量关系写方程式;
(5)根据反应3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O进行判断.
解答:
解:(1)铝、铁、铜的合金中只有铝与KOH溶液反应,生成AlO2-和H2,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)溶液C通过调节pH可以使Fe3+沉淀完全,应加入CuO、碱式碳酸铜或氢氧化铜,而加入铜粉生成Fe2+,加入氨水引入新的杂质,故答案为:CD;
(3)已知溶液的pH=4,则c(H+)=10-4mol/L,c(OH-)=10-10mol/L,Ksp[Fe(OH)3]=4.0×10-38=c(Fe3+)×c3(OH-),所以c(Fe3+)=4.0×10-8mol/L;
已知溶液中氢氧根离子的浓度为10-10mol/L,则Qc=c(Cu2+)×c2(OH-)=1×(10-10)2=10-20<Ksp[Cu(OH)2]=2.2×10-20,所以没有氢氧化铜沉淀生成;
故答案:4.0×10-8;无;
(4)将20mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70mL混合,则二者的物质的量之比为2:7,则反应时铝离子与氢氧根离子的物质的量之比为1:3.5,所以有部分氢氧化铝转化为偏铝酸根离子,其离子方程式为:2Al3++3SO42-+3Ba2++7OH-═AlO2-+Al(OH)3↓+3BaSO4↓+2H2O;
故答案为:2Al3++3SO42-+3Ba2++7OH-═AlO2-+Al(OH)3↓+3BaSO4↓+2H2O;
(5)n(HNO3)=0.1L×2mol/L=0.2mol,n(H2SO4)=0.1L×3mol/L=0.3mol,
则n(H+)=0.2mol+2×0.3mol=0.8mol,n(NO3-)=0.2mol,n(Cu)=0.3mol,
由反应3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,0.2molNO3-完全被还原;
故答案为:0.2mol.
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)溶液C通过调节pH可以使Fe3+沉淀完全,应加入CuO、碱式碳酸铜或氢氧化铜,而加入铜粉生成Fe2+,加入氨水引入新的杂质,故答案为:CD;
(3)已知溶液的pH=4,则c(H+)=10-4mol/L,c(OH-)=10-10mol/L,Ksp[Fe(OH)3]=4.0×10-38=c(Fe3+)×c3(OH-),所以c(Fe3+)=4.0×10-8mol/L;
已知溶液中氢氧根离子的浓度为10-10mol/L,则Qc=c(Cu2+)×c2(OH-)=1×(10-10)2=10-20<Ksp[Cu(OH)2]=2.2×10-20,所以没有氢氧化铜沉淀生成;
故答案:4.0×10-8;无;
(4)将20mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70mL混合,则二者的物质的量之比为2:7,则反应时铝离子与氢氧根离子的物质的量之比为1:3.5,所以有部分氢氧化铝转化为偏铝酸根离子,其离子方程式为:2Al3++3SO42-+3Ba2++7OH-═AlO2-+Al(OH)3↓+3BaSO4↓+2H2O;
故答案为:2Al3++3SO42-+3Ba2++7OH-═AlO2-+Al(OH)3↓+3BaSO4↓+2H2O;
(5)n(HNO3)=0.1L×2mol/L=0.2mol,n(H2SO4)=0.1L×3mol/L=0.3mol,
则n(H+)=0.2mol+2×0.3mol=0.8mol,n(NO3-)=0.2mol,n(Cu)=0.3mol,
由反应3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,0.2molNO3-完全被还原;
故答案为:0.2mol.
点评:本题主要考查了物质的分离提纯和制备,题目涉及离子反应方程式的书写、除杂质、氧化还原反应、溶度积的有关计算等,综合性较强,题目难度中等,侧重于考查学生对基础知识的综合应用能力.

练习册系列答案
相关题目
膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示.下列有关芥子醇的说法正确的是( )
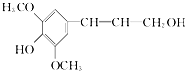

| A、芥子醇的分子式是C11H14O4,属于芳香烃 |
| B、芥子醇分子中所有碳原子不可能在同一平面上 |
| C、芥子醇与足量浓溴水反应,最多消耗1 mol Br2 |
| D、芥子醇能发生的反应类型有氧化、取代、加成 |
在无色透明的溶液中可以大量共存的离子组是( )
| A、Mg2+、K+、Cl-、NO3- |
| B、H+、K+、HCO3-、NO3- |
| C、Cu2+、NO3-、SO42-、Cl- |
| D、OH-、Cl-、Na+、Al3+ |
用已知浓度的NaOH溶液滴定未知浓度的盐酸溶液,下列说法正确的是会使测定结果偏高的( )
| A、滴定前对碱式滴定管仰视读数,滴定后又俯视,会使测定结果偏高 |
| B、滴定管和锥形瓶使用之前均需用所装溶液润洗 |
| C、用酚酞做指示剂,滴定终点是当最后一滴NaOH溶液滴入时,溶液颜色由无色变为浅红色,且半分钟内不变色 |
| D、滴定前锥形瓶内含有少量水对实验结果无影响 |
A、B的转化率随其物质的量之比的变化曲线如图所示,该反应可能是( )


| A、A+B?C |
| B、3A+2B?2C |
| C、3A+B?2C |
| D、A+3B?C |