题目内容
食用加碘盐的生产流程如下: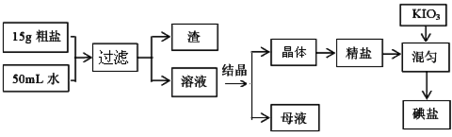
(1)检验母液中是否含有SO42-离子的方法是 。
(2)过滤时,用到的玻璃仪器有: 、 、 。
(3)国家标准GB546061-92规定碘盐含碘量(以碘计):出厂产品≥40mg/Kg;销售品≥30mg/Kg。某次实验时向一干净的坩埚中放入5g精盐,加入1mL0.001mol/L标准KIO3溶液搅拌均匀,在100℃恒温烘干1 h,即得碘盐产品,该碘盐的含碘量约为______mg/Kg(保留一位小数),是否为合格产品 (选填“合格”或“不合格”)。
(4)检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO3-+5CNS-+H++2H2O→3I2+5HCN+5SO42-,检验时,除需用KCNS外,还需要使用的一种试剂是 。
(5)使用碘盐时,要防止高温,是因为:① 碘盐中的碘酸钾在560℃开始分解产生无色气体,剩余固体中加硝酸酸化的硝酸银溶液有黄色沉淀生成;② 碘盐在热水中,也会反应生成两种单质,其中一种是无色气体,在反应后的溶液中滴加酚酞试液显红色。根据以上信息写出①、②中发生反应的化学方程式:
① ;
② 。
(1)取少量母液先加入稀盐酸酸化,再加入BaCl2溶液,若有白色沉淀,则说明有SO42-离子。(2分)
(2)漏斗、玻璃棒、烧杯(3分)
(3)25.4(2分),不合格(1分)
(4)淀粉溶液(1分)
(5)2KIO3 2KI+3O2↑(1分);12KIO3+6H2O
2KI+3O2↑(1分);12KIO3+6H2O 6I2+12KOH+15O2↑(2分)
6I2+12KOH+15O2↑(2分)
解析试题分析:(3)KIO3----------KI -------I
1*0.001 1*0.001
1*0.001* 127/5/1000=25.4(mg/Kg) 因为出厂产品≥40mg/Kg ,25.4mg/Kg<40mg/Kg 不合格
(4)因为I2遇淀粉变蓝。
(5)硝酸酸化的硝酸银溶液有黄色沉淀生成,证明有I-,以KI的形式存在,碘酸钾加热除生成KI还生成O2,碘盐在热水中,也会反应生成两种单质,其中一种是无色气体O2;另一种为I2,滴加酚酞试液显红色证明有KOH生成,根据氧化还原法配平。
考点:本题以化工生产为基础,考查元素及其化合物和实验等知识。

 阅读快车系列答案
阅读快车系列答案X、Y、Z、W是元素周期表前四周期的常见元素,其相关信息如下表:
| X | X的一种核素的质子数为56,中子数为30 |
| Y | 海水中元素含量最高的金属元素 |
| Z | 常温常压下,Z单质是淡黄色固体,常在火山口附近沉积 |
| W | 价电子的排布式为3s23p3 |
(1)Z元素在元素周期表中的位置为 ,Z的电负性比W的 (填“大”或“小”)。
(2)X元索的基态原子电子排布式是 _ ,其有___种运动状态不同的电子。该元素的白色氧氧化物在空气中会迅速变成灰绿色。最后变成红褐色、其反应的化学方程式为 。
(3)Y的单质在工业上用途广泛,工业上以YW制取Y单质的化学方程式为 。
(4)设计实验验证Z和W的非金属性的强弱: 。
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大。有关信息如下表:
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
(1)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,请写出该气态氢化物的电子式____________。
(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族。下列有关说法正确的是____________(填序号)。
A.原子半径: Rb>I
B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(3)化合物QX导热性好,热膨胀系数小,是良好的耐热冲击材料。抗熔融金属侵蚀的能力强,是熔铸纯铁、铝或铝合金理想的坩埚材料。有关化合物QX的制备及化学性质如下(所有热量数据均已折合为25℃、101.3 kPa条件下的数值)
可用Q和X的单质在800 ~ 1000℃制得,每生成1 mol QX,吸收a kJ的热量。
可用Q的氧化物、焦炭和X的单质在1600 ~ 1750℃生成QX,每生成1 mol QX,消耗18 g碳,吸收b kJ的热量。
请根据上述信息写出在理论上Q的氧化物跟焦炭反应生成Q单质和CO的热化学方程式________________。
(4)X、Y组成的一种无色气体遇空气变为红棕色。将标准状况下40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐。请写出该反应的离子方程式 。
abcd是四种短周期元素。a、b、d同周期,c、d同主族.a原子结构示意图 ,b与c形成化合物的电子式为如图
,b与c形成化合物的电子式为如图 。下列比较中正确的是
。下列比较中正确的是
| A.原子半径:a >c>d | B.非金属性:a >b>d |
| C.单质的熔点:c> a | D.最高价氧化物对应的水化物的酸性:c>d>a |
几种短周期元素的原子半径和主要化合价见下表,下列说法中正确的是( )。
| 元素代号 | 原子半径/nm | 主要化合价 |
| X | 0.160 | +2 |
| Y | 0.143 | +3 |
| Z | 0.102 | +6、-2 |
| L | 0.099 | +7、-1 |
| M | 0.077 | +4、-4 |
| Q | 0.074 | -2 |
B.Y与Q形成的化合物不能跟氢氧化钠溶液反应
C.Z的氢化物的稳定性强于L的氢化物的稳定性
D.在化学反应中,M原子与其他原子易形成共价键而不易形成离子键
元素性质呈周期性变化的决定因素是
| A.元素原子半径大小呈周期性变化 | B.元素原子的原子序数依次增加 |
| C.元素的最高正化合价呈周期性变化 | D.元素原子最外层电子排布呈周期性变化 |
已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物,则下列说法错误的是 ( )
| A.Y和Z可以组成一种Y和Z的质量比为7:8的化合物 |
| B.X、Y、Z三种元素可以组成一种盐 |
| C.X和Z可以组成原子个数比分别为1:1和2:1常温下为液态的两种化合物 |
| D.由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒有2种 |