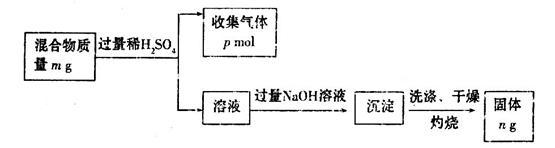
题目内容
将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物。
(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式_______________。
(2)B、D都是酸性氧化物且组成元素相同,D溶于水得强酸,则B、D分子中除氧元素外所含另一种元素在周期表中的位置是_______________。
(3)E能使湿润的红色石蕊试纸变蓝,实验室制取E气体的化学方程式为________________,制得的气体可用如图所示装置收集,则气体应从_______(填“A”或“B”)通入。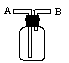
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,则其化学式为___________,若向X的浓溶液中滴加浓NaOH溶液至过量,现象依次为_______________ 、___________ _、
_____________ 。
(5)取一定量的X晶体分解,若生成F 1 mol,则必同时生成_______ 物质_____ mol。
(1)Al2O3+2OH-=2AlO2-+H2O (2)第三周期,ⅥA族
(3)Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O; B
CaCl2+2NH3↑+2H2O; B
(4)NH4Al(SO4)2·12H2O;生成白色沉淀;生成刺激性气味的气体;白色沉淀又逐渐溶解
(5)SO2;3
解析试题分析:(1)A能溶于强酸、强碱,且A是氧化物,所以A是氧化铝,氧化铝与强碱溶液反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O。
(2)B、D都是酸性氧化物且组成元素相同,D溶于水得强酸,所以B是SO2,D是三氧化硫,因此则B、D分子中除氧元素外所含另一种元素是硫,硫元素在周期表中的位置是第三周期第ⅥA族。
(3)E能使湿润的红色石蕊试纸变蓝,则E是氨气,实验室制取E气体的化学方程式为Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O。氨气密度小于空气的,所以用如图所示装置收集氨气时应该从B口通入。
CaCl2+2NH3↑+2H2O。氨气密度小于空气的,所以用如图所示装置收集氨气时应该从B口通入。
(4)气体E是单质F所含元素的氢化物,所以F是氮气。即X分解产物是氧化铝、SO2、三氧化硫、氨气、氮气和水。又因为X的结构类似于明矾,所以根据明矾的化学式KAl(SO4)2·12H2O可知X的化学式为NH4Al(SO4)2·12H2O;向X的溶液中滴加浓氢氧化钠溶液,OH-首先结合Al3+生成白色沉淀氢氧化铝,然后与NH4+结合放出刺激性气味的气体氨气,最好再溶解氢氧化铝,白色沉淀消失,因此实验现象依次为生成白色沉淀;生成刺激性气味的气体;白色沉淀又逐渐溶解。
(5)X如果分解生成1mol氮气,则氮元素的化合价从-3价升高到0价,失去3个电子,即生成1mol氮气失去6mol电子。S元素的化合价从+6降低到+4价,得到2个电子,所以根据电子得失守恒可知生成SO2的物质的量是6mol÷2=3mol。
考点:考查氧化铝、SO2、三氧化硫性质;氨气制备;晶体化学式的确定以及氧化还原反应的计算等

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案请你利用下列装置来证明浓硫酸与足量锌反应时可得到SO2、H2两种气体,所需试剂自选。
(1)在下面的方框中,画出实现上述实验目的的装置示意图(仪器选自于下图,夹持装置、连接胶管、橡皮塞及尾气处理装置不必画出,也不必标出装置内试剂,需要加热的仪器下方用△标出),按气流流向在每件仪器下方标出字母A、B、C……其他可选用的仪器(数量不限)简易表示如下: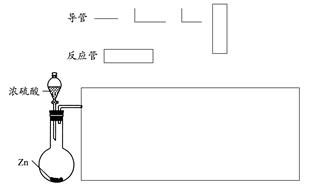
(2)根据方框中的装置图,填写下表:
| 仪器符号 | 仪器中所加物质 | 作用 |
| | | |
| 最后一种装置(作图时请对其编号) | 浓硫酸 | 防止空气中水蒸气进入E中干扰实验 |
过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
★过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下: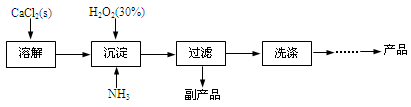
(1)用上述方法制取CaO2·8H2O的化学方程式是 。
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
① ;② 。
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200 mol·L—1KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+ =2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为 。
(4)根据表1数据,计算产品中CaO2·8H2O的质量分数(写出计算过程)
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
下列基态原子或离子核外未成对电子数目为5的是
| A.Fe3+ | B.P | C.Cr | D.Cu |
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,电子层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是
| A.Z与Y形成的化合物可作为耐高温材料 |
| B.WY2能与碱反应,但不能与任何酸反应 |
| C.原子半径按X、Y、Z、R、W的顺序依次增大 |
| D.熔沸点:X2R>X2Y |

 b.
b. c.
c.