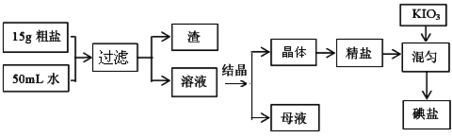
题目内容
X、Y、Z、W是元素周期表前四周期的常见元素,其相关信息如下表:
| X | X的一种核素的质子数为56,中子数为30 |
| Y | 海水中元素含量最高的金属元素 |
| Z | 常温常压下,Z单质是淡黄色固体,常在火山口附近沉积 |
| W | 价电子的排布式为3s23p3 |
(1)Z元素在元素周期表中的位置为 ,Z的电负性比W的 (填“大”或“小”)。
(2)X元索的基态原子电子排布式是 _ ,其有___种运动状态不同的电子。该元素的白色氧氧化物在空气中会迅速变成灰绿色。最后变成红褐色、其反应的化学方程式为 。
(3)Y的单质在工业上用途广泛,工业上以YW制取Y单质的化学方程式为 。
(4)设计实验验证Z和W的非金属性的强弱: 。
(1)第三周期ⅥA族;小(各1分)
(2)[Ar]3d64s2(1分);26(1分);4Fe(OH)2+O2+2H2O=4Fe(OH)3(2分)
(3)2NaCl(熔融) 2Na+Cl2↑(2分)
2Na+Cl2↑(2分)
(4)将氯水滴入硫化氢水溶液中,出现淡黄色的沉淀,说明氯元素的非金属性强于硫元素的非金属性(其他合理答案均可)(3分)
解析试题分析:根据题意X、Y、Z、W分别是铁、钠、硫、氯。
(1)硫位于第三周期ⅥA族;硫的电负性小于氯。
(2)铁的电子排布式为:[Ar]3d64s2;原子核外没有运动状态相同的电子,共有26种;
反应为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(3)2NaCl(熔融) 2Na+Cl2↑。
2Na+Cl2↑。
(4)将氯水滴入硫化氢水溶液中,出现淡黄色的沉淀,说明氯元素的非金属性强于硫元素的非金属性(其他合理答案均可)
考点:利用元素推断考察周期表(律)、元素及其化合物的性质。

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
美国科学家将两种元素铅和氪的原子核对撞,获得了一种质量数为293、中子数为175的超重元素,该元素原子的质子数为
| A.118 | B.175 | C. 47 | D.293 |


 b.
b.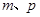 c.
c.