题目内容
20.2016年是门捷列夫诞辰182周年.下列事实用元素周期律不能解释的是( )| A. | 沸点:H2O>H2S | B. | 碱性:KOH>NaOH | ||
| C. | 酸性:HClO4>H2SO4 | D. | 元素的金属性:Mg>Al |
分析 A.水中含氢键,则水的沸点高;
B.金属性越强,对应碱的碱性越强;
C.非金属性越强,对应最高价含氧酸的酸性越强;
D.同周期从左向右金属性减弱.
解答 解:A.水中含氢键,硫化氢不含,则沸点:H2O>H2S,与元素周期律无关,故A选;
B.金属性K>Na,对应碱的碱性KOH>NaOH,可利用周期律解释,故B不选;
C.非金属性Cl>S,对应最高价含氧酸的酸性为HClO4>H2SO4,可利用周期律解释,故C不选;
D.同周期从左向右金属性减弱,则元素的金属性:Mg>Al,可利用周期律解释,故D不选;
故选A.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
10.下列物质属于强电解质的是( )
| A. | KNO3 | B. | CO2 | C. | H2O | D. | CH3COOH |
11.除去下列物质中的杂质(小括号中物质),所用试剂正确的是( )
| A. | NaHCO3(Na2CO3)向溶液中通入CO2 | B. | Cl2(HCl)通入饱和NaCl溶液中 | ||
| C. | NaOH(Na2CO3)加足量Ba(OH)2 溶液 | D. | CO2(HCl)通入Na2CO3溶液中 |
8.下列化合物中,只含有离子键的是( )
| A. | Na2O2 | B. | KOH | C. | KCl | D. | HCl |
15.已知15P、33As位于同一主族.下列关系正确的是( )
| A. | 原子半径:As>Cl>P | B. | 非金属性:Cl>S>As | ||
| C. | 热稳定性:HCl>AsH3>PH3 | D. | 酸性:H3AsO4>H2SO4>H3PO4 |
5.下列物质①过氧化钠、②氧化铝、③纯碱、④二氧化硅.根据它们的用途填空:(填序号)
(1)可作制玻璃原料的是③
(2)可用于呼吸面具中作为氧气来源的是①
(3)能作光导纤维的是④
(4)能作耐火材料的是②.
(1)可作制玻璃原料的是③
(2)可用于呼吸面具中作为氧气来源的是①
(3)能作光导纤维的是④
(4)能作耐火材料的是②.
12.下列关于反应能量的说法正确的是( )
| A. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| B. | 相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子所具有的能量为E2,则2E1>E2 | |
| C. | 101kPa时,2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ•mol-1,H2的燃烧热为571.6kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ•mol-1,含1molNaOH的氢氧化钠溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量 |
9.海水中含有氯化镁,从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳,②在引入海水的水渠中加石灰乳,沉降、过滤、洗涤沉淀物,③将沉淀物与盐酸反应,结晶过滤、干燥产物,④将得到的产物熔融后电解.关于提取镁,下列说法不正确的是( )
| A. | 此法的优点之一是原料丰富 | |
| B. | 进行①②③步骤的目的是从海水中提取MgCl2 | |
| C. | 第④步电解时同时会产生氯气 | |
| D. | 以上提取镁的过程中涉及到的反应有分解反应、化合反应和置换反应 |
2.由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如图所示的电解装置,可制得白色纯净的Fe(OH)2沉淀.两个电极的材料分别为石墨和铁.下列说法不正确的是( )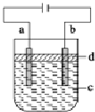

| A. | a电极的材料应为铁 | |
| B. | d为苯,其作用为防止空气中的O2把Fe(OH)2氧化 | |
| C. | 电解液c可以是NaCl溶液、NaOH溶液等 | |
| D. | 若电解过程中阳极消耗铁11.2g,理论上阴极产生气体为4.48L |