题目内容
电子工业常用FeCl3溶液腐蚀印刷电路板上不需要的铜箔,最后得到含FeCl3、FeCl2杂质的CuCl2溶液.某化学兴趣小组设计下列方案,从该废液中除去FeCl3、FeCl2杂质,制取纯净的CuCl2.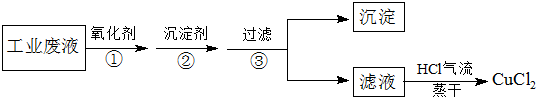
请回答下列问题:
(1)在①步操作中使用了氧化剂,下列氧化剂中一定不能使用的是
A.Cl2 B.NaClO C.H2O2 D.KMnO4 E.O3
(2)②步操作中的“沉淀剂”可以是下列中的
A.NaOH B.NH3?H2O C.CuO D.Cu2(OH)2CO3 E.Fe2O3
用一种你选择的沉淀剂,分步写出除去杂质的离子方程式: .
(3)最后将滤液在HCl气流中蒸干,其目的是,如果将滤液直接加热蒸干,最后得到的固体可能是.
(4)设常温下各沉淀的溶度积近似为:Ksp[Cu(OH)2]=10-20、Ksp[Fe(OH)3]=10-38、Ksp[Fe(OH)2]=10-16;通常,人们把浓度小于10-5 mol/L的离子视为“不存在”.根据所给条件,完成下列问题:
①如果该废液中CuCl2的浓度为1mol/L,在加沉淀剂时应调节溶液的pH值范围为:.
②如果对废液不先用氧化剂,而是直接加入沉淀剂,带来的后果是: .

请回答下列问题:
(1)在①步操作中使用了氧化剂,下列氧化剂中一定不能使用的是
A.Cl2 B.NaClO C.H2O2 D.KMnO4 E.O3
(2)②步操作中的“沉淀剂”可以是下列中的
A.NaOH B.NH3?H2O C.CuO D.Cu2(OH)2CO3 E.Fe2O3
用一种你选择的沉淀剂,分步写出除去杂质的离子方程式:
(3)最后将滤液在HCl气流中蒸干,其目的是,如果将滤液直接加热蒸干,最后得到的固体可能是.
(4)设常温下各沉淀的溶度积近似为:Ksp[Cu(OH)2]=10-20、Ksp[Fe(OH)3]=10-38、Ksp[Fe(OH)2]=10-16;通常,人们把浓度小于10-5 mol/L的离子视为“不存在”.根据所给条件,完成下列问题:
①如果该废液中CuCl2的浓度为1mol/L,在加沉淀剂时应调节溶液的pH值范围为:.
②如果对废液不先用氧化剂,而是直接加入沉淀剂,带来的后果是:
考点:物质分离和提纯的方法和基本操作综合应用
专题:
分析:从该废液中除去FeCl3、FeCl2杂质,制取纯净的CuCl2工艺流程如下:加入氧化剂,将氯化亚铁氧化为氯化铁,加入沉淀剂调节溶液的PH使铁离子形成氢氧化铁沉淀,过滤,滤液为CuCl2溶液,在HCl气流中蒸干得到氯化铜.
(1)根据加入的氧化剂需氧化亚铁离子,但不能引入杂质影响制取纯净的CuCl2;
(2)根据加入的沉淀剂能使铁离子形成沉淀,且不引入新的杂质分析解答;
(3)氯化铜中的铜离子易水解,在酸性环境下可以抑制水解,如果将滤液直接加热蒸干,最后得到的固体可能是Cu(OH)2(包含CuO);
(4)①依据氢氧化铜饱和溶液中溶度积常数计算溶液中的氢离子浓度计算pH;结合氢氧化铁溶度积和残留在溶液中的离子浓度小于1×10-5 mol?L-1时就认为沉淀完全;
②如果对废液不先用氧化剂,而是直接加入沉淀剂,带来的后果是不能除去Fe2+或者杂质除去时CuCl2已完全沉淀而除去了;
(1)根据加入的氧化剂需氧化亚铁离子,但不能引入杂质影响制取纯净的CuCl2;
(2)根据加入的沉淀剂能使铁离子形成沉淀,且不引入新的杂质分析解答;
(3)氯化铜中的铜离子易水解,在酸性环境下可以抑制水解,如果将滤液直接加热蒸干,最后得到的固体可能是Cu(OH)2(包含CuO);
(4)①依据氢氧化铜饱和溶液中溶度积常数计算溶液中的氢离子浓度计算pH;结合氢氧化铁溶度积和残留在溶液中的离子浓度小于1×10-5 mol?L-1时就认为沉淀完全;
②如果对废液不先用氧化剂,而是直接加入沉淀剂,带来的后果是不能除去Fe2+或者杂质除去时CuCl2已完全沉淀而除去了;
解答:
解:(1)因亚铁离子和次氯酸钠反应生成氢氧化铁、氯离子和铁离子,6Fe2++3ClO-+3H2O=2Fe(OH)3↓+3Cl-+4Fe3+,生成氢氧化铁,引入氯化钠杂质所以不选,因亚铁离子和高锰酸钾反应MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,引入锰离子,所以不选,A.Cl2 C.H2O2 E.O3,氧化亚铁离子不引入杂质,所以能选,
故答案为:BD;
(2)由工艺流程转化关系可知,试剂②应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,且不能引入新的杂质,可利用Fe3++3H2O?Fe(OH)3+3H+,加入沉淀剂使平衡右移,
A.氢氧化钠不仅和铁离子反应形成沉淀,也和铜离子反应形成沉淀,故A错误;
B.氨水不仅和铁离子反应形成沉淀,也和铜离子反应形成沉淀,故B错误;
C.CuO难溶于水和H+反应,CuO+2H+=Cu2++H2O 溶液pH增大,使Fe3+转化为Fe(OH)3,不引入杂质,故C正确;
D.Cu2(OH)2CO3 难溶于水,中和H+,Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑,溶液pH增大,使Fe3+转化为Fe(OH)3,不引入杂质,故D正确;
E.Fe2O3难溶于水,无法除去溶于中的铁离子,故E错误;
故答案为:CD;Fe3++3H2O?Fe(OH)3+3H+;CuO+2H+=Cu2++H2O 或Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑;
(3)氯化铜中的铜离子易水解,在干燥的HCl气流中,抑制了CuCl2水解,且带走CuCl2受热产生的水汽,故能得到无水CuCl2,如果将滤液直接加热蒸干,最后得到的固体可能是Cu(OH)2(包含CuO),
故答案为:抑制CuCl2水解;Cu(OH)2(包含CuO亦可);
(4)①Cu(OH)2的溶度积Ksp=1.0×10-20,溶液中CuSO4的浓度为1.0mol?L-1,c(Cu2+)=1.0mol?L-1;依据溶度积常数c(Cu2+)×c2(OH-)=1.0×10-20;c2(OH-)=
=10-20;得到c(OH-)=10-10mol/L,依据水溶液中的离子积c(H+)×c(OH-)=10-14;求的c(H+)=10-4mol/L,溶液pH=4,则Cu(OH)2开始沉淀时溶液的pH为4;
残留在溶液中的离子浓度小于1×10-5 mol?L-1时就认为沉淀完全,Fe(OH)3的溶度积Ksp=1.0×10-38,c(Fe3+)×c3(OH-)=1.0×10-38;c3(OH-)=
=1.0×10-33;求的c(OH-)=1×10-11mol/L;水溶液中的离子积c(H+)×c(OH-)=10-14;c(H+)=1×10-4mol/L,则pH=3;通过计算可知pH=4能达到除去Fe3+而不损失Cu2+的目的,
故答案为:3≤pH<4;
②根据以上分析,如果对废液不先用氧化剂,而是直接加入沉淀剂,带来的后果是不能除去Fe2+或者杂质除去时CuCl2已完全沉淀而除去了,
故答案为:不能除去Fe2+或者杂质除去时CuCl2已完全沉淀而除去了;
故答案为:BD;
(2)由工艺流程转化关系可知,试剂②应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,且不能引入新的杂质,可利用Fe3++3H2O?Fe(OH)3+3H+,加入沉淀剂使平衡右移,
A.氢氧化钠不仅和铁离子反应形成沉淀,也和铜离子反应形成沉淀,故A错误;
B.氨水不仅和铁离子反应形成沉淀,也和铜离子反应形成沉淀,故B错误;
C.CuO难溶于水和H+反应,CuO+2H+=Cu2++H2O 溶液pH增大,使Fe3+转化为Fe(OH)3,不引入杂质,故C正确;
D.Cu2(OH)2CO3 难溶于水,中和H+,Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑,溶液pH增大,使Fe3+转化为Fe(OH)3,不引入杂质,故D正确;
E.Fe2O3难溶于水,无法除去溶于中的铁离子,故E错误;
故答案为:CD;Fe3++3H2O?Fe(OH)3+3H+;CuO+2H+=Cu2++H2O 或Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑;
(3)氯化铜中的铜离子易水解,在干燥的HCl气流中,抑制了CuCl2水解,且带走CuCl2受热产生的水汽,故能得到无水CuCl2,如果将滤液直接加热蒸干,最后得到的固体可能是Cu(OH)2(包含CuO),
故答案为:抑制CuCl2水解;Cu(OH)2(包含CuO亦可);
(4)①Cu(OH)2的溶度积Ksp=1.0×10-20,溶液中CuSO4的浓度为1.0mol?L-1,c(Cu2+)=1.0mol?L-1;依据溶度积常数c(Cu2+)×c2(OH-)=1.0×10-20;c2(OH-)=
| 1.0×10-20 |
| 1.0 |
残留在溶液中的离子浓度小于1×10-5 mol?L-1时就认为沉淀完全,Fe(OH)3的溶度积Ksp=1.0×10-38,c(Fe3+)×c3(OH-)=1.0×10-38;c3(OH-)=
| 1.0×10-38 |
| 1.0×10-5 |
故答案为:3≤pH<4;
②根据以上分析,如果对废液不先用氧化剂,而是直接加入沉淀剂,带来的后果是不能除去Fe2+或者杂质除去时CuCl2已完全沉淀而除去了,
故答案为:不能除去Fe2+或者杂质除去时CuCl2已完全沉淀而除去了;
点评:本题考查化学工艺流程、元素化合物性质等,掌握元素化合物的性质、混合物的分离、提纯方法是解决本题的关键,注意沉淀转化的原理应用,除杂的原理应用,主要是溶解沉淀的转化关系的分析应用,题目难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
由14CO和12CO组成的混合气体与同温同压下空气的密度相等(空气的平均相对分子质量为29,)则下列关系正确的是( )
| A、混合气体中,12CO占有的体积大于14CO占有的体积 |
| B、混合气体中,12CO与14CO分子个数比为1:2 |
| C、混合气体中,12CO与14CO质量比为15:14 |
| D、混合气体中,12CO与14CO密度比为14:15 |
下列各组均为两种化合物溶于水时电离出的离子,其中由酸电离产生的是( )
| A、Na+、OH-、SO42- |
| B、H+、SO42-、Cl- |
| C、Na+、K+、OH- |
| D、K+、Na+、Cl- |
下列关于有机化合物的说法正确的是( )
| A、分子式为C3H6O2的链状有机物中含有一个双键 |
| B、1 mol甲烷与Cl2完全发生取代反应需2 mol Cl2 |
| C、1 mol乙烯与Cl2完全发生加成反应需2 mol Cl2 |
| D、乙醇与乙酸均能被酸性KmnO4溶液氧化 |
在2L的密闭容器中把4molA和2molB混合,在一定条件下发生反应3A(g)+2B(g)?zC(g)+2D(g).2min后反应达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol/(L?min).则下列说法不正确的是( )
| A、z=4 | ||
| B、B的转化率是40% | ||
| C、A的平衡浓度是1.4mol/L | ||
D、平衡时气体压强是原来的
|
利用如图装置(瓶口向上)不可行的实验是( )


| A、A口进气,B口排气,用于收集H2 |
| B、广口瓶充满水,从A中进气用于收集O2 |
| C、广口瓶中盛有浓硫酸,从B口进气用于干燥SO2气体 |
| D、广口瓶盛有NaOH水溶液,从B中进气用于除去Cl2中的HCl气体 |
下列说法正确的是( )
| A、液氨汽化时要吸收大量的热,可用作制冷剂 |
| B、二氧化硫可广泛用于食品的漂白 |
| C、碘是人体必需微量元素,所以要多吃富含高碘酸的食物 |
| D、氯化铝是一种电解质,可用于电解法制铝 |