题目内容
下列关于有机化合物的说法正确的是( )
| A、分子式为C3H6O2的链状有机物中含有一个双键 |
| B、1 mol甲烷与Cl2完全发生取代反应需2 mol Cl2 |
| C、1 mol乙烯与Cl2完全发生加成反应需2 mol Cl2 |
| D、乙醇与乙酸均能被酸性KmnO4溶液氧化 |
考点:取代反应与加成反应,有机物结构式的确定,乙醇的化学性质,乙酸的化学性质
专题:
分析:A、链状饱和烃的含氧衍生物分子式应为C3H8O2,不饱和度为
=1,分子中含有1个双键.
B、甲烷与氯气发生完全取代反应为CH4+4Cl2→CCl4+4HCl,据此计算需要的氯气.
C、乙烯分子中含有1个C=C双键,1mol双键与氯气发生加成,需要氯气1mol.
D、只要是羟基所在的碳上有一个氢就可以被高锰酸钾氧化成酮类,羟基所在的碳上有两个氢就可以被高锰酸钾氧化成羧酸.
| 8-6 |
| 2 |
B、甲烷与氯气发生完全取代反应为CH4+4Cl2→CCl4+4HCl,据此计算需要的氯气.
C、乙烯分子中含有1个C=C双键,1mol双键与氯气发生加成,需要氯气1mol.
D、只要是羟基所在的碳上有一个氢就可以被高锰酸钾氧化成酮类,羟基所在的碳上有两个氢就可以被高锰酸钾氧化成羧酸.
解答:
解:A、链状饱和烃的含氧衍生物分子式应为C3H8O2,不饱和度为
=1,分子中含有1个双键,故A正确;
B、甲烷与氯气发生完全取代反应为CH4+4Cl2→CCl4+4HCl,由方程式可知,1mol甲烷与Cl2完全发生取代反应需4molCl2,故B错误;
C、乙烯分子中含有1个C=C双键,1mol双键与氯气发生加成,需要氯气1mol,故C错误;
D、羟基所在的碳上有2个氢就可以被高锰酸钾氧化为乙酸,乙酸不能被酸性高锰酸钾氧化,故D错误.
故选A.
| 8-6 |
| 2 |
B、甲烷与氯气发生完全取代反应为CH4+4Cl2→CCl4+4HCl,由方程式可知,1mol甲烷与Cl2完全发生取代反应需4molCl2,故B错误;
C、乙烯分子中含有1个C=C双键,1mol双键与氯气发生加成,需要氯气1mol,故C错误;
D、羟基所在的碳上有2个氢就可以被高锰酸钾氧化为乙酸,乙酸不能被酸性高锰酸钾氧化,故D错误.
故选A.
点评:本题主要考查烷、烯、醇、羧酸的性质与结构,比较基础,旨在考查学生对基础知识的掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
决定物质体积大小的主要因素,其中不包括( )
| A、微粒间引力 |
| B、微粒的数目 |
| C、微粒的大小 |
| D、微粒间平均距离 |
当温度达到374℃,压强为2.2×104KPa时,水处于超临界状态,此时水具有较高浓度的H+和OH-,能溶解更多的有机物质,下列对临界状态水的推测正确的是( )
| A、超临界水的pH较常温时升高 |
| B、超临界水的离子积增大 |
| C、超临界水发生了化学变化 |
| D、大多数有机物在超临界水中溶解度更小 |
关于工业转化图(见图),下列说法不正确的是( )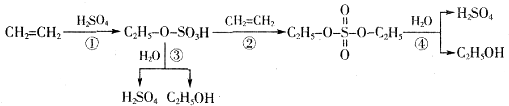

| A、该过程是一种“对环境友好型”工业生产硫酸的方法 |
| B、从以上物质的转化过程可看出硫酸可作乙烯水化法制乙醇的催化剂 |
| C、该过程中①②是加成反应 |
| D、该过程中③④是酯类的水解 |
下列实验操作说法不正确的是( )
| A、实验室蒸馏石油时,冷凝管水流方向应从上到下与蒸汽流动方向相同 |
| B、蒸发结晶时不必将溶液加热到蒸干 |
| C、萃取操作必须在分液漏斗中进行 |
| D、用剩的药品应收集起来放回指定的回收处 |
25℃时,pH=2的酸和pH=12的碱溶液等体积混合后,恢复至原温,溶液呈酸性.其原因可能是( )
| A、生成了一种强酸弱碱盐 |
| B、等浓度的强酸和弱碱溶液反应 |
| C、浓的弱酸溶液和稀的强碱溶液反应 |
| D、浓的强酸和稀的强碱溶液反应 |