题目内容
19.共价键、离子键、分子间作用力都是粒子间的作用力,含有以上两种作用力的晶体是( )| A. | SiO2 | B. | CCl4 | C. | NaCl | D. | 金刚石 |
分析 一般金属元素与非金属元素形成离子键,非金属元素之间形成共价键,离子晶体中含有离子键,以共价键结合的物质可能为原子晶体,也可能为分子晶体,在分子晶体中还存在分子间作用力,以此来解答.
解答 解:A.SiO2中只有共价键,为原子晶体,故A不选;
B.CCl4属于分子晶体,C与Cl间形成共价键,分子间存在分子间作用力,所以含有两种作用力,故B选;
C.NaCl是离子化合物,由钠离子和氯离子构成,只存在离子键,故C不选;
D.金刚石是原子晶体,晶体中只存在于共价键,故D不选.
故选B.
点评 本题考查化学键和晶体,为高频考点,注意化学键的形成规律及分子晶体中存在分子间作用力即可解答,注意分子中存在分子间作用力是学生解答的难点,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.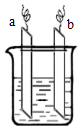 如图中ab相连后,两电极上发生的电极反应分别为:
如图中ab相连后,两电极上发生的电极反应分别为:
a极:2Ag++2e-=2Ag b极:Zn-2e-=Zn2+
下列说法不正确的是( )
 如图中ab相连后,两电极上发生的电极反应分别为:
如图中ab相连后,两电极上发生的电极反应分别为:a极:2Ag++2e-=2Ag b极:Zn-2e-=Zn2+
下列说法不正确的是( )
| A. | a极材料一定为金属银 | |
| B. | b极为负极 | |
| C. | 装置中电解质溶液一定含有Ag+ | |
| D. | 装置中发生的反应方程式一定是Zn+2Ag+=Zn2++2Ag |
10.下列关于有机反应类型的说法错误的是( )
| A. | 烯烃、炔烃、苯环、醛和葡萄塘在一定条件下均可与H2发生加成反应 | |
| B. | 卤代烃的水解反应、酯的水解反应均为取代反应 | |
| C. | 乙醇发生的分子内脱水反应、分子间脱水反应均为消去反应 | |
| D. | 乙醇、乙烯均可在一定条件下发生氧化反应生成乙醛 |
7.下列除杂质的操作方法正确的是( )
| A. | NO中有少量的NO2:用水洗涤后再干燥 | |
| B. | 食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干 | |
| C. | O2中有少量的CO:通过灼热的氧化铜 | |
| D. | NO2中有少量NH3:用水洗涤后干燥 |
14.NA代表阿伏加德罗常数的值.下列说法正确的是( )
| A. | 含2.8 mol电子的Mg34S晶体中34S所含中子数为1.8NA | |
| B. | 17gH2O2中所含极性键总数为0.5NA | |
| C. | 31gFeI2与足量氯气反应时转移的电子数为0.2NA | |
| D. | 以Mg、Al为电极,NaOH 溶液为电解质溶液的原电池中,若正极生成的H2体积为22.4L,导线上流过2NA个电子 |
4.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 25℃时,1 LpH=l的硫酸溶液中,含有H+的数目为0.2NA | |
| B. | 1 mol Na2O2与水完全反应时转移电子数目为2 NA | |
| C. | 向含1 mol Cl-的NH4Cl溶液中加入氨水使溶液呈中性,此时溶液中NH4+数目为NA | |
| D. | 向2 mL0.5 mol/L硅酸钠溶液中滴入过量盐酸制硅酸胶体,所得胶粒数目为0.001 NA |
11.用NA代表阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA | |
| B. | 氢气与氯气反应生成标准状况下22.4L氯化氢,断裂化学键的总数为2NA | |
| C. | 1mol的白磷(P4)或四氯化碳(CCl4)中所含的共价健数均为4NA | |
| D. | 工业上电解饱和氯化钠溶液,得到标准状况下22.4L氢气时,转移的电子数为2NA |
8.实验室制备乙酸乙酯和乙酸丁酯采用的相同措施是( )
| A. | 水浴加热 | B. | 冷凝回流 | ||
| C. | 用浓硫酸做脱水剂和催化剂 | D. | 乙酸过量 |
10.表是周期表中的一部分,根据A-I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的单质是F2,还原性最强的单质是Na;
(2)最高价氧化物的水化物碱性最强的化合物是NaOH,酸性最强的化合物是HClO4,呈两性的化合物是Al(OH)3;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)在B、C、D、E、F、G、H中,原子半径最大的是Na.
(5)写出E的单质的结构式N≡N:
(6)写出BG组成的化合物的形成过程 :
:
| 族周期 | ⅠA | 0 | ||||||
| 1 | A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的化合物是NaOH,酸性最强的化合物是HClO4,呈两性的化合物是Al(OH)3;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)在B、C、D、E、F、G、H中,原子半径最大的是Na.
(5)写出E的单质的结构式N≡N:
(6)写出BG组成的化合物的形成过程
 :
: