题目内容
3.下列反应中,CO2作氧化剂的是( )| A. | Ca(OH)2+CO2=CaCO3↓+H2O | B. | CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO | ||
| C. | 2Fe2O3+3C$\frac{\underline{\;高温\;}}{\;}$4Fe+3CO2↑ | D. | CO+H2O$\frac{\underline{\;\;△\;\;}}{\;}$H2+CO2 |
分析 CO2作氧化剂,则反应中C元素的化合价降低,以此来解答.
解答 解:A.没有元素的化合价变化,为非氧化还原反应,故A不选;
B.CO2中C元素的化合价降低,则作氧化剂,故B选;
C.CO2为生成物,不作氧化剂,故C不选;
D.CO2为生成物,不作氧化剂,故D不选.
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化剂判断的考查,题目难度不大.

练习册系列答案
相关题目
15.下列说法中正确的是( )
| A. | 18 g H2O在标准状况下的体积是22.4 L | |
| B. | 1molFe与足量Cl2完全反应,转移电子2mol | |
| C. | 在常温常压下,22.4 L Cl2含6.02×1023个氯气分子 | |
| D. | 48g O2和O3的混合气体含有3mol氧原子 |
16.托卡朋是基于2012年诺贝尔化学奖研究成果开发的治疗帕金森氏病的药物,其部分合成路线如图
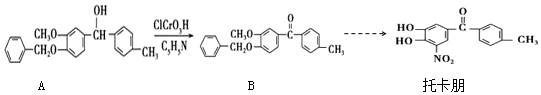
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 托卡朋的分子式为C14H11NO5 | |
| B. | 反应A→B的类型属于取代反应 | |
| C. | 托卡朋分子中所有的碳原子有可能在同平面内 | |
| D. | 托卡朋能发生加成反应 |
11.相同温度下,三个容器中分别盛有N2、H2、NH3.若三个容器中气体的密度相等,则下列说法中正确的是( )
| A. | 三种气体的质量相等 | |
| B. | 三种气体的物质的量之比为28:2:17 | |
| C. | 三种气体的压强之比为$\frac{1}{28}$:$\frac{1}{2}$:$\frac{1}{17}$ | |
| D. | 三个容器的容积之比为17:2:28 |
8.等质量的下列物质所含分子数最多的是( )
| A. | 金刚石 | B. | 臭氧 | C. | 干冰 | D. | 纯碱 |
15.在含有Cl-、Na+、Br-、CO32-的溶液中加入过量的硝酸银溶液,产生沉淀后,加入过量稀硝酸,沉淀部分溶解,并有气泡放出,描述述现象的离子方程式错误的是( )
| A. | Ag++Cl-→AgCl↓ | B. | Ag++Br-→AgBr↓ | ||
| C. | Ag++CO32-→AgCO3↓ | D. | Ag2CO3+2H+→2Ag++CO2↑+H2O |
13.能用键能大小解释的事实是( )
| A. | 稀有气体化学性质很稳定 | B. | 硝酸易挥发,而硫酸难挥发 | ||
| C. | 氮气的化学性质比氧气稳定 | D. | 常温常压下,溴呈液态,碘呈固态 |
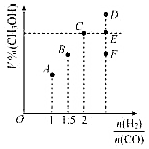 在工业上常用CO和H2合成甲醇,反应方程式为:CO(g)+2H2(g)?CH3OH(g)△H=a kJ/mol.
在工业上常用CO和H2合成甲醇,反应方程式为:CO(g)+2H2(g)?CH3OH(g)△H=a kJ/mol.