题目内容
14.肼(N2H4)是一种高能燃料,常温下是液体,燃烧产生巨大能量,可作为航天火箭的推动力.下列叙述中正确的是( )| A. | N2H4的摩尔质量为32 | |
| B. | 1 molN2H4的质量为32 g•mol-1 | |
| C. | 在标准状况下,1 mol N2H4的体积约为22.4L | |
| D. | 6.02×1023个N2H4分子的质量为32g |
分析 A.摩尔质量的单位为g/mol;
B.质量的单位为g,g/mol为摩尔质量的单位;
C.标准状况下N2H4的状态不是气态;
D.6.02×1023个N2H4分子的物质的量为1mol,根据m=nM计算其质量.
解答 解:A.N2H4的摩尔质量为32g/mol,故A错误;
B.1 molN2H4的质量为32 g•mol-1×1mol=32g,故B错误;
C.在标准状况下,N2H4不是气体,不能使用标准状况下的气体摩尔体积计算,故C错误;
D.6.02×1023个N2H4分子的物质的量为1mol,其质量为:32 g•mol-1×1mol=32g,故D正确;
故选D.
点评 本题考查了物质的量的计算,题目难度不大,明确摩尔质量、质量的概念及单位即可解答,注意熟练掌握物质的量与其它物理量之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
5.已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ•mol-1;
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1.
CO2与H2反应生成甲烷气体与液态水的热化学方程式为CO2(g)+4H2(g)═CH4(g)+2H2O(l)△H3,则△H3为( )
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1.
CO2与H2反应生成甲烷气体与液态水的热化学方程式为CO2(g)+4H2(g)═CH4(g)+2H2O(l)△H3,则△H3为( )
| A. | -252.9 kJ•mol-1 | B. | +252.9 kJ•mol-1 | C. | -604.5 kJ•mol-1 | D. | +604.5 kJ•mol-1 |
9.短周期主族元素X、Y、Z、W的原子序数依次增大,它们的最外层电子数之和为22,Y的单质广泛用作半导体材料,Z原子的最外层电子数是最内层电子数的3倍.下列说法不正确的是( )
| A. | 原子半径:r(Y)>r(Z)>r(W) | |
| B. | 简单气态氢化物的热稳定性:Y<Z | |
| C. | 氧化物的水化物的酸性:Z<W | |
| D. | X的简单氢化物与W的氢化物相遇可产生白烟 |
6.下列关于苯的说法错误的是( )
| A. | 苯是无色有特殊气味的烃,燃烧时冒浓烟 | |
| B. | 苯一定条件下能与浓硫酸和浓硝酸的混酸溶液发生取代反应 | |
| C. | 苯不存在单双键交替结构,不能和溴水发生加成反应 | |
| D. | 工业上的苯都是从煤干馏获取的煤焦油中分离得到 |
4.下列溶液中,氯离子浓度最大的是( )
| A. | 10mL 0.2mol/L的FeCl3溶液 | B. | 10mL 0.1mol/L的AlCl3溶液 | ||
| C. | 20mL 0.1mol/L的MgCl2溶液 | D. | 20mL 0.1mol/L的KClO3溶液 |
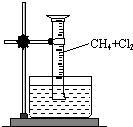 某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验.
某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验.



