题目内容
将下列各组物质混合后,溶液中一定有沉淀生成的是( )
| A、Al2(SO4)3溶液与过量氨水 |
| B、NaOH溶液与AlCl3溶液 |
| C、NaAlO2溶液与盐酸 |
| D、少量CO2通入CaCl2溶液 |
考点:镁、铝的重要化合物
专题:元素及其化合物
分析:A、氨水和铝盐反应生成氢氧化铝沉淀,氢氧化铝沉淀不溶于氨水;
B、AlCl3中加入NaOH先生成Al(OH)3,发生3NaOH+AlCl3=Al(OH)3↓+3NaCl,Al(OH)3具有两性,可与NaOH反应生成NaAlO2,发生Al(OH)3+NaOH=NaAlO2+2H2O;
C.NaAlO2溶液与盐酸反应产物和盐酸量的多少有关;
D.氯化钙不与二氧化碳反应.
B、AlCl3中加入NaOH先生成Al(OH)3,发生3NaOH+AlCl3=Al(OH)3↓+3NaCl,Al(OH)3具有两性,可与NaOH反应生成NaAlO2,发生Al(OH)3+NaOH=NaAlO2+2H2O;
C.NaAlO2溶液与盐酸反应产物和盐酸量的多少有关;
D.氯化钙不与二氧化碳反应.
解答:
解:A、将少量浓氨水滴入Al2(SO)4溶液和将少量Al2(SO4)3溶液滴入浓氨水可以用同一离子方程式表示,Al3++3NH3?H2O=Al(OH)3↓+3NH4+;故A正确;
B、AlCl3中加入NaOH先生成Al(OH)3,发生Al3++3OH-═Al(OH)3↓,Al(OH)3具有两性,继续加入NaOH溶液则发生Al(OH)3+OH-═AlO2-+2H2O,可观察到沉淀溶解,故B错误;
C.NaAlO2溶液与少量盐酸反应产物是氯化钠和氢氧化铝,和过量的盐酸反应产物是氯化铝和氯化钠,故C错误;
D.氯化钙和二氧化碳不符合离子发生反应的条件,故不发生反应,故D错误;
故选A.
B、AlCl3中加入NaOH先生成Al(OH)3,发生Al3++3OH-═Al(OH)3↓,Al(OH)3具有两性,继续加入NaOH溶液则发生Al(OH)3+OH-═AlO2-+2H2O,可观察到沉淀溶解,故B错误;
C.NaAlO2溶液与少量盐酸反应产物是氯化钠和氢氧化铝,和过量的盐酸反应产物是氯化铝和氯化钠,故C错误;
D.氯化钙和二氧化碳不符合离子发生反应的条件,故不发生反应,故D错误;
故选A.
点评:本题考查了物质之间的反应,明确物质的性质是解本题关键,涉及反应物的量、产物的性质,能正确书写方程式,题目难度中等.

练习册系列答案
相关题目
不能鉴别AgNO3、BaCl2、K2SO3和Mg(NO3)2四种溶液(不考虑他们间的相互反应)的试剂组是( )
| A、盐酸、硫酸 |
| B、盐酸、NaOH溶液 |
| C、氨水、硫酸 |
| D、氨水、NaOH溶液 |
实验室有一瓶久置的K2SO3粉末,为确定其是否变质进行的下述实验结论正确的是( )
| A、进行元素分析,测得粉末中K和S两种元素的质量比为39:16,则该粉末没有变质 |
| B、将粉末溶于水,加入氯化钡,有白色沉淀生成,则该粉末变质了 |
| C、将粉末加入盐酸中,产生气泡,则该粉末没有变质 |
| D、将粉末溶于水,滴加过量的盐酸,有气泡产生,再加入氯化钡溶液,有白色沉淀生成,则该粉末部分变质 |
据报道,月球的土壤中吸附着数百万吨的 He,每百吨 He核聚变所释放出的能量相当于目前人类一年消耗的能量.地球上氦元素主要以42He的形式存在下列说法正确的是( )
| A、42He原子核内有4个质子 |
| B、42He的最外层电子数为2 |
| C、32He原子核内含有3个质子 |
| D、32He与42He互为同位素 |
用惰性电极电解100mL含0.02molCuSO4溶液,当有0.08NA个e-通过时,停止电解,要使电解质溶夜恢复到原来的浓度,需向电解后的溶液中加入的物质是( )
| A、CuO |
| B、CuCO3 |
| C、Cu(OH)2 |
| D、Cu2(OH)2CO3 |
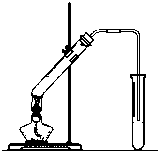 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: